 C . 沉淀b中滴加氨水发生反应的离子方程式:AgCl+2NH3∙H2O=[Ag(NH3)2]++Cl-+2H2O
D . 从实验现象可以得出该温度下Ksp(Ag2S)>Ksp(Ag2SO4)
C . 沉淀b中滴加氨水发生反应的离子方程式:AgCl+2NH3∙H2O=[Ag(NH3)2]++Cl-+2H2O
D . 从实验现象可以得出该温度下Ksp(Ag2S)>Ksp(Ag2SO4)






亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成ClO2、HClO2、ClO2﹣、Cl﹣等,其中HClO2和ClO2都具有漂白作用.已知pOH=﹣lgc(OH﹣),经测定25℃时各组分含量随pOH变化情况如图所示(Cl﹣没有画出),此温度下,下列分析错误的是( )


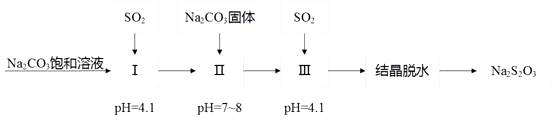 ①pH=4.1时,1中为溶液(写化学式)。
①pH=4.1时,1中为溶液(写化学式)。
②工艺中加入Na2CO3 , 固体,并再次充入SO2的目的是。

写出制备CaO2·8H2O的化学方程式;
a固氧:碱性下,O2将Mn2+氧化为MnO(OH)2:2Mn2++O2+4OH−=2MnO(OH)2↓;
b氧化:酸性下,MnO(OH)2将I−氧化为I2;
c滴定:用Na2S2O3标准溶液滴定生成的I2:2S2O +I2 =S4O
+ 2I-
某同学向100.00mL水中加一定量CaO2·8H2O,取此水样50.00mL,按上述方法测定水中溶氧量(DO),消耗 0.02 mol·L−1 Na2S2O3标准溶液 15.00 mL。
请写出步骤 b 中的离子方程式 ;

有关物质性质如下表:
| 甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,难溶于乙醇 |
| 两性化合物 | 强酸性、强还原性 |
实验过程:
I.合成:装置C中盛有0.1mol FeCO3和200mL 1.0mol·L−1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置C中空气排净后,加热C并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
Ⅱ.分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:

已知:
| 氢氧化物 | | | | | |
| 开始沉淀时的pH | 2.3 | 4.0 | 7.5 | 8.8 | 10.4 |
| 沉淀完全时的pH | 4.1 | 5.2 | 9.7 | 10.4 | 12.4 |
回答下列问题:

实际生产中,酸浸时控制硫酸的量不宜过多,使 在2左右。请结合上图和制备硫酸锰的流程,说明硫酸的量不宜过多的原因:。


已知:① 的浓度较大时易分解爆炸,一般用
或空气稀释到
以下,实验室也常用稳定剂吸收
,生成
,使用时加酸只释放出
一种气体;
② 与
反应的离子方程式为:
;
③有关物质沸点如下表:
| 物质 | | | |
| 沸点 | | | |
请回答:
查阅资料:
① 为紫色固体,微溶于
溶液,具有强氧化性,在酸性或中性溶液中快速产生
,在碱性溶液中较稳定。
② 与
溶液在20℃以下反应生成
,在较高温度下则生成
。
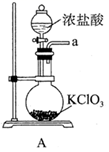
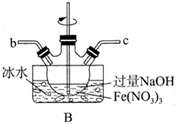
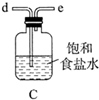
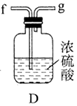
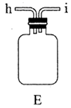
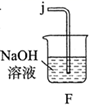
①滴定时选用的指示剂是,滴定终点的现象是。
②制得粗 的纯度是。
已知发生的反应为:
,该溶液中维生素C的物质的量是mol。写出简要的计算过程。

已知:①NH4VO3是白色粉末,微溶于冷水,可溶于热水。
②NH4VO3 V2O5+2NH3↑+H2O
③V2O5是一种橙黄色片状晶体,微溶于水,不溶于乙醇,具有强氧化性。
④部分稀土金属氯化物在乙醇中溶解度较小。
(已知:I2+2Na2S2O3=Na2S4O6+2NaI,结果保留三位有效数字)


注:气体流速管是用来测量单位时间内通过气体的体积的装置
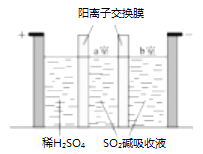
①用上述装置定量测定空气中的SO2和可吸入颗粒的含量,除测定气体流速(单位:cm3·min-1)外还需要测定、。
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。请你协助甲组同学完成100mL 5×10-4mo1• L-1碘溶液的配制:
第一步:用电子天平准确称取1.27g碘单质加入烧杯中,。
第二步:将第一步所得溶液和洗涤液全部转入 mL的容量瓶中,加水定容,摇匀。
第三步:从第二步所得溶液中取出10.00mL溶液倒入100mL容量瓶中,加水稀释至刻度线,摇匀。

①检查该装置的气密性时,先在试管中装入适量的水(保证玻璃管的下端浸没在水中)。然后(填写操作方法)时。将会看到(填写实验现象),则证明该装置的气密性良好。
②测定指定地点空气中的SO2含量准确移取1.00mL 5×10-4mo1•L-1碘溶液,注入如图所示试管中。用适量的蒸馏水桸释后,再加2~3滴淀粉溶液,配制成溶液A。甲、乙两组同学分别使用如图所示相同的实验装置和溶液A,在同一地点、同时推拉注射器的活塞,反复抽气,直到溶液的蓝色全部褪尽为止停止抽气,记录抽气次数如下(假设每次抽气500mL)。
| 分组 | 甲组 | 乙组 |
| 抽气次数 | 110 | 145 |
我国环境空气质量标准对空气质量测定中SO2的最高浓度限值如下表:
| 最高浓度限值/mg·m-3 | ||
| 一级标准 | 二级标准 | 三级标准 |
| 0.15 | 0.50 | 0. 70 |
经老师和同学们分析,判断甲组测定结果更为准确,则该地点的空气中SO2 的含量为mg•m-3(保留2 位有效数字),属于(填汉字)级标准;请你分析乙组实验结果产生较大偏差的原因是(两个小组所用装置和药品均无问题)。

气体产物成分的探究。小组成员采用如下装置可重复选用)进行实验:

①E中盛装碱石灰的仪器名称为。
②按照气流从左到右的方向,上述装置的接口顺序为a→g→f→→尾气处理装置(仪器可重复使用)。
③实验前先通入一段时间N2 , 其目的为。
④实验证明了气体产物中含有CO,依据的实验现象为。
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品并溶于稀HSO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用 cmol/L KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4 , 再用 cmol/L KMnO4标准溶液滴定至终点,消耗标准液V2mL。
步骤2中滴定终点的现象为;步骤3中加入锌粉的目的为。

注:SS表示固体悬浮物
模拟工业处理流程如下:

已知:i.常温时CaSO4微溶于水; ii.溶解度: CaSO4>Fe(OH)2>FeS。

②废水中SS含量随时间变化如下表所示。
静置时间(h) | 1 | 2 | 3 | 4 | 5 | 6 | 24 |
SS含量(mg/L) | 2500 | 1800 | 1300 | 900 | 820 | 800 | 780 |
为降低成本,减少硫酸投加量的最好办法是。
③滤渣A的主要成分有SS和。

①化学絮凝沉淀过程中,加入FeSO4发生反应的离子方程式是。
②熟石灰能促进沉淀的生成,结合离子方程式,从平衡角度分析其原因是。

已知:①浸出液含有的阳离子主要有H+、Co2+、Ca2+、Mg2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体是 (填化学式)。
A.2.0~2.5
B.3.0~3.5
C.4.0~4.5
D.5.0~5.5

Ⅰ.工业级硝酸锶中常含有硝酸钙、硝酸钡等杂质,其中硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸。提纯硝酸锶的实验步骤如下:
①取含杂质的硝酸锶样品,向其中加入浓HNO3溶解,搅拌。
②过滤,并用浓HNO3洗涤滤渣。
③将滤渣溶于水中,加略过量铬酸使Ba2+沉淀,静置后加入肼(N2H4)将过量铬酸还原,调节pH至7~8,过滤。
④将滤液用硝酸调节pH至2~3,蒸发浓缩,冷却结晶,过滤,洗涤。
⑤将得到的Sr(NO3)2·2H2O晶体在100 ℃条件下干燥,得到高纯硝酸锶。
完成下列填空:

①NH4Al(SO4)2溶液中所有离子的浓度由大到小的顺序是,请解释阳离子浓度差异的原因.
②写出N点反应的离子方程式.
③若向10mL1mol/L NH4Al(SO4)2溶液中加入20mL1.2mol/LBa(OH)2溶液,充分反应后,产生沉淀 mol.
Mg(s)+H2(g)=MgH2(s)△H1=﹣74.5kJ•mol﹣1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s)△H2=﹣64.4kJ•mol﹣1
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s)△H3
则△H3=kJ•mol﹣1
步骤1:准确称量3.50g产品配成100mL溶液.
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL 1.000mol•L﹣1的FeSO4溶液,微热.
步骤3:冷却至室温,用0.100mol•L﹣1 K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72﹣+6Fe2++14H+═2Cr3++6Fe3++7H2O.
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL.产品中Mg(ClO3)2•6H2O的纯度为(用百分号表示,精确到小数点后一位)
以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.在不同温度下催化剂的催化效率与乙酸的生成速率如1图所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是

①如果寻找吸收CO2的其它物质,下列建议合理的是
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4 , Li4SiO4用于吸收、释放CO2 , 原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2 , Li4SiO4再生,说明该原理的化学方程式是