

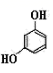
 中位于同一平面的原子数目最多为14 NA
B . 巯基(-SH)的电子式为
中位于同一平面的原子数目最多为14 NA
B . 巯基(-SH)的电子式为 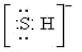 C . N2H4的结构式:
C . N2H4的结构式:  D . 常温下,1L 0.2mol/L AlCl3溶液中含Al3+数为0.2NA
D . 常温下,1L 0.2mol/L AlCl3溶液中含Al3+数为0.2NA


②X难溶于水,但可溶于氨水中,写出该反应的离子方程式。
|
物质 |
CO2(g) |
H2O(g) |
CH3OH(g) |
|
ΔfH |
-393.5 |
-241.8 |
-205.0 |

在868K、0.1MPa和催化剂作用下,混合气(体积含量:SO28.0%、O211.8%,其余气体不反应)在一恒压密闭容器内开始反应。10min后达到平衡,混合气中O2含量为10.0%,则SO2的转化率为,该条件下的压强平衡常数K=;工业生产中通常使用比868K低的温度,其主要考虑的因素有(填字母)。
a.反应速率 b.催化剂活性 c.原料转化率 d.生产设备
O3+NO=NO2+O2、O3+NO2=NO3+O2、NO3+NO2=N2O5
已知:i.Na2SO3+NCl3 + ![]() =Na2SO4+ HCl+NH4Cl;
=Na2SO4+ HCl+NH4Cl;
ⅱ.BaCl2+Na2SO4=BaSO4↓十2HCl。
①请完成反应i的化学方程式(横线填数字,方框中填化学式):
ⅰ Na2SO3+NCl3+ ![]() =Na2SO4+ HCl+NH4Cl
=Na2SO4+ HCl+NH4Cl
②装置B反应后的溶液中三氯化氮的浓度为mol·L-1。

已知:实验室中常用 溶液与
溶液反应制取
;
能溶于水和乙醇。
回答下列问题:
猜测1:钠分别与水、盐酸反应,由于,钠与盐酸反应更快。
猜测2:钠分别与乙醇、醋酸反应,由于醋酸,钠与醋酸反应更快。
实验I配制一定浓度的HCl
①用12.00mol·L-1HCl配制0.50mol·L-1HCl和5.00mol·L-1HCl时,除用到烧杯、胶头滴管、玻璃棒外,还必须用到下列仪器中的(写对应字母)。

②配制0.50mol·L-1HCl250mL,需要取用12.00mol·L-1浓盐酸的体积为。
实验II相同温度下,比较钠与水、0.50mol·L-1HCl、5.00mol·L-1HCl反应的快慢
| 序号 | 钠块(形状几乎相同) | 反应液体(50mL) | 钠块消失时间 |
| Ⅰ | 0.15g | 水 | Ⅱ<Ⅰ<Ⅲ |
| Ⅱ | 0.15g | 0.50mol·L-1HCl | |
| Ⅲ | 0.15g | 5.00mol·L-1HCl |
该小组查阅资料知,相同温度下,影响钠与盐酸反应速率的主要因素是c(H+)和钠表面的c(Na+)。
③钠与5.00mol·L-1HCl反应,速率最慢的原因可能是。
实验II相同温度下,比较钠与乙醇、醋酸反应的快慢
| 序号 | 钠块(形状几乎相同) | 反应液体(50mL) | 反应现象 | 钠块消失时间 |
| ⅳ | 0.15g | 乙醇 | 钠沉在烧杯底部,产生气泡较快 | ⅳ<ⅴ |
| ⅴ | 0.15g | 冰醋酸 | 钠浮在液体表面,产生气泡较慢 |
④该小组某同学提出,依据化学实验的控制变量思想,该实验设计存在缺陷,该缺陷是。
⑤请你帮助该小组设计新的方案,对上述实验进行改进。
实验结论:
⑥通过实验探究,该小组同学认为钠与醋酸反应比钠与乙醇反应慢,原因可能是。
A.冰醋酸是无水乙酸,无水情况下难以电离出氢离子
B.乙醇钠在乙醇中的溶解度大于乙酸钠在乙酸中的溶解度
C.乙酸羧基中的氢原子比乙醇羟基中的氢原子更难电离出氢离子

分液漏斗及2号气瓶中盛放浓度为150g·L-1的NaClO2溶液,1号气瓶中盛放6mol·L-1的H2SO4溶液,3号、4号、5号、6号气瓶中盛放冰水。回答下列问题:
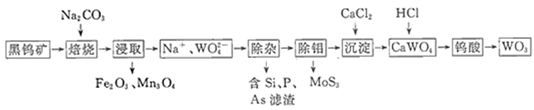
回答下列问题: