|
时间/min |
4 |
6 |
8 |
10 |
t |
20 |
25 |
35 |
|
|
4.230 |
2.510 |
1.790 |
1.350 |
1.240 |
1.130 |
1.110 |
1.100 |
下列叙述正确的是( )

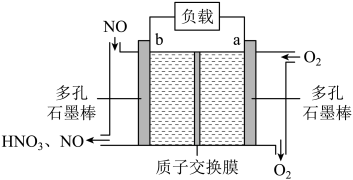
 )广泛应用于航天化工等领域中,其电化学制备原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂),下列说法正确的是( )
)广泛应用于航天化工等领域中,其电化学制备原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂),下列说法正确的是( ) 
| 离子 | | | | | | | |
| 含量 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |




①阳极的电极反应式为
②简述浓缩室中得到浓乳酸的原理:
③电解过程中,采取一定的措施可控制阳极室的 pH 约为 6~8,此时进入浓缩室的OH-可忽略不计。400 mL 10 g∙L −1 乳酸溶液通电一段时间后,浓度上升为 145 g∙L −1 (溶液体积变化忽略不计),阴极上产生的 H2 在标准状况下的体积约为L。(乳酸的摩尔质量为90 g•mol-1)
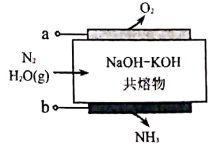
a.饱和食盐水 b.饱和氢氧化钠溶液 c.饱和亚硫酸钠溶液
请写出碳酸钠水溶液中通入气体的化学方程式。

图中①处填,②处填。
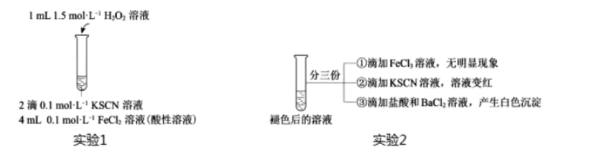
用实验2探究“红色褪去”的原因,则红色褪去的原因是。