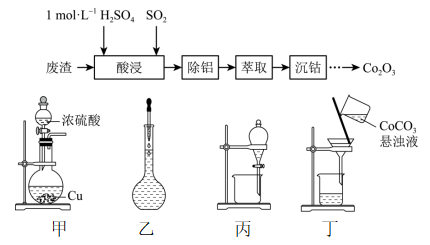
 B .
B .  B .
B .  C .
C .  D .
D . 

 B . “氧化”时,试剂可选用O2、H2O2或Br2
C . 上述流程包括三个氧化还原反应和三种分离操作
D . “反萃取”时,反应的离子方程式为I2+2OH-=I-+IO
B . “氧化”时,试剂可选用O2、H2O2或Br2
C . 上述流程包括三个氧化还原反应和三种分离操作
D . “反萃取”时,反应的离子方程式为I2+2OH-=I-+IO已知几种物质的部分性质如表所示:
物质 | 熔点/℃ | 沸点/℃ | 溶解性 |
丙酮 | -95 | 56 | 与水、乙醇互溶 |
碘仿 | 123 | 218 | 不溶于水,溶于热乙醇 |
 C .
C .  D .
D . 

 D .
D .
|
|
|
|
A.洗气 | B.干燥气体 | C.用水吸收NH3 | D.排空气法收集H2 |
物质 | 熔点/℃ | 沸点/℃ | 溶解性 |
丙酮( | -95 | 56 | 与水、乙醇互溶 |
碘仿( | 120 | 218 | 不溶于水,溶于热乙醇 |
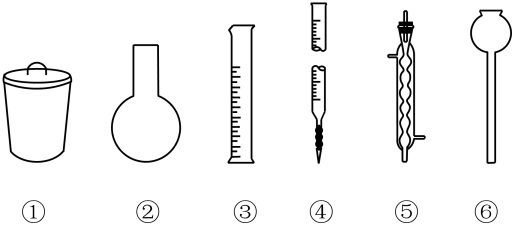
制得的粗碘仿中含少量石墨粉、丙酮,则分离提纯碘仿的操作中,图中仪器一定不会用到的( )

 B .
B .  C .
C .  D .
D . 

| 选项 | 实验目的 | 玻璃仪器 | 试剂 |
| A | 溴乙烷中溴元素的检验 | 试管、量筒、胶头滴管、酒精灯 | 溴乙烷、 |
| B | | 酒精灯、蓝色钴玻璃 | |
| C | 实验室制取氯气 | 圆底烧瓶、分液漏斗、导管、广口瓶、烧杯 | |
| D | 葡萄糖的银镜反应实验 | 试管、酒精灯、烧杯、量筒、胶头滴管 | 10%葡萄糖溶液、新制的银氨溶液、蒸馏水 |
| 实验目的 | 玻璃仪器 | 试剂 | |
| A | 测定NaHCO3的浓度 | 酸式滴定管、锥形瓶、烧杯 | 待测NaHCO3溶液、标准盐酸溶液、甲基橙指示剂 |
| B | 检测稀硫酸作用后的淀粉是否水解 | 试管、胶头滴管、酒精灯 | 氢氧化钠溶液、硫酸铜溶液 |
| C | 对比Fe3+、Cu2+对H2O2分解的催化效果 | 试管、胶头滴管 | 5%H2O2溶液、0. 1 mol/L Fe2(SO4)3溶液、0.1 mol/L CuSO4溶液 |
| D | 除去粗盐中的 | 试管、普通漏斗、胶头滴管 | 稀盐酸、BaCl2、Na2CO3溶液 |
Ⅰ.取已知浓度的溶液,搅拌下滴加足量
溶液,产生浅蓝色沉淀。加热,沉淀转变成黑色,过滤。
Ⅱ.向草酸()溶液中加入适量
固体,制得
和
混合溶液。
Ⅲ.将Ⅱ的混合溶液加热至80~85 ℃,加入Ⅰ中的黑色沉淀。全部溶解后,趁热过滤。
Ⅳ.将Ⅲ的滤液用蒸汽浴加热浓缩,经一系列操作后,干燥,得到二草酸合铜(Ⅱ)酸钾晶体,进行表征和分析。
回答下列问题:

①称取 ,配成
溶液,转移至恒压滴液漏斗中。
②向三颈烧瓶中加入 溶液。
③持续磁力搅拌,将 溶液以
的速度全部滴入三颈烧瓶中,100℃下回流3h。
④冷却后过滤,依次用热水和乙醇洗涤所得黑色沉淀,在 干燥。
⑤管式炉内焙烧2h,得产品3.24g。
部分装置如图:

回答下列问题:
可供选择的试剂: 、
、
、
、饱和
、饱和
可供选择的发生装置(净化装置略去):
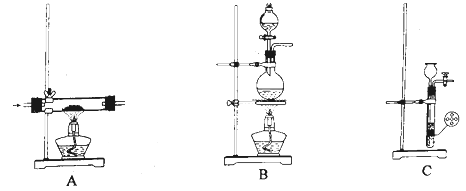

实验过程:检验装置气密性后,在圆底烧瓶中加入5g无水三氯化铝和10mL无水乙醇,点燃酒精灯加热。
请回答相关问题:

①取一定量于烧杯中溶解,分批次加入适量浓氨水,搅拌、过滤、洗涤、干燥。
②将、乙二胺四乙酸、
加入三颈烧瓶(装置如图),用
溶液调节pH,搅拌、80℃水浴反应1h,经过一系列操作,洗涤,晾干得到产品。

回答下列问题:
①指示剂为。
②计算可知,样品中的质量分数为%。
③若滴定过程较为缓慢,则测得样品中的质量分数偏大,其原因是。
 +Br2
+Br2实验操作:先将铁粉和苯加入反应器a(如图所示)中,在搅拌下缓慢加入液溴,于70-80℃保温反应数小时,得棕褐色液体。将棕褐色液体转移到分液漏斗中,依次用水洗、5%氢氧化钠溶液洗、水洗、干燥。过滤,最后经常压分馏,收集155-157℃馏分。相关物质有关数据如下:
苯 | 溴 | 溴苯 | |
密度:g/cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中的溶解度 | 微溶 | 微溶 | 微溶 |

请回答下列问题:
物质 | 化学式 | 相对分子质量 | 熔点/ | 沸点/ | 相对密度 | 溶解性 |
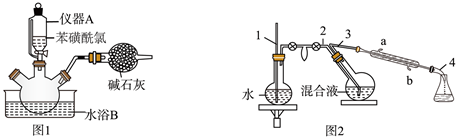
苯硫酚 | 110 | 169.5 | 1.07 | 难溶于水 | ||
苯磺酰氯 | 176.5 | 14.5 | 251 | 1.38 | 难溶于水 |
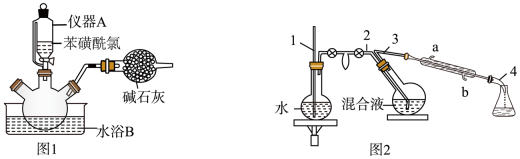
操作步骤:
①向三口烧瓶中加入冰和
浓硫酸。
②再向三口烧瓶中慢慢加入苯磺酰氯,尽快地分次加入
锌粉,继续反应
, 温度保持在
左右,如图1。
③撤去水浴B,微热三口烧瓶,并保持一定的回流。反应平稳后,再加热。
④将反应后的混合液进行水蒸气蒸馏,分出苯硫酚,如图2。
⑤加入氯化钙,经操作X得粗品。再进行蒸馏,收集馏分,得纯品
。
回答下列问题:
a.冰盐水浴 b.冷水浴 c.热水浴

已知CS2是一种难溶于水的无色液体,密度为1.26g/cm3 , NH3难溶于CS2。回答下列问题:
①仪器B的名称是。
②三颈烧瓶左侧导管口必须插入到下层的CS2液体中,主要原因是(写出一条原因即可)。
①熄灭A处的酒精灯,关闭K1 , 移开水浴,将装置C继续加热至105℃,NH4HS完全分解后(化学方程式为NH4HSNH3↑+H2S↑),打开K2 , 继续保持溶液温度为105℃,缓缓滴入适量的KOH溶液,制得KSCN溶液。反应的化学方程式为。
②装置D可用于处理尾气,已知酸性重铬酸钾溶液能将H2S氧化生成浅黄色沉淀,铬元素被还原为Cr3+ , 写出其氧化H2S的离子方程式。
①将称得的样品配制成溶液,所使用的仪器除烧杯和玻璃棒外还有。;在滴定管中装入KSCN溶液的前一步,应进行的操作为;NH4Fe(SO4)2溶液的作用是。
②产品中KSCN质量分数为(列出计算式,KSCN摩尔质量为97 g/mol);若其它操作正确,在滴定终点读取滴定管刻度时,俯视滴定管内液体液面,则最后测定结果(填“偏大”“偏小”或“不受影响”)。
①2S(s) + Cl2(g) S2Cl2(l);
②S2Cl2(l)+ Cl2(g) = 2SCl2(l)。
已知相关物质的性质如下表所示:
物质 | 外观 | 熔点/℃ | 沸点/℃ | 水溶性 |
S | 淡黄色粉末 | 118 | 445 | 不溶 |
S2Cl2 | 黄红色液体 | -80 | 138 (分解) | 剧烈反应 |
SCl2 | 红棕色液体 | -78 | 60 | 剧烈反应 |
某小组在实验室模拟工业制备二氯化硫时设计了如下实验装置(部分夹持装置已略去) 。

回答下列问题:

硫渣的化学组成
| 物质 | Sn | Cu2S | Pb | As | 其他杂质 |
| 质量分数% | 64.43 | 25.82 | 7.34 | 1.23 | 1.18 |
氯气与硫渣反应相关产物的熔沸点
| 物质 性质 | SnCl4 | CuCl | PbCl2 | AsCl3 | S |
| 熔点/℃ | -33 | 426 | 501 | -18 | 112 |
| 沸点/℃ | 114 | 1490 | 951 | 130 | 444 |
①AsCl3+3H2O= H3AsO3+ 3HCl
②H3AsO3+I2+H2O= H3AsO4+2HI
③2 +I2=2I-+
则产品中SnCl4的质量分数(保留小数点后1位);若滴定后发现滴管尖嘴处产生了气泡,则测量结果(填“偏高”或“偏低”)。
| 物质 | 化学式 | 相对分子质量 | 熔点/ | 沸点/ | 相对密度 | 溶解性 |
| 苯硫酚 | | 110 | | 169.5 | 1.07 | 难溶于水 |
| 苯磺酰氯 | | 176.5 | 14.5 | 251 | 1.38 | 难溶于水 |
操作步骤:
①向三口烧瓶中加入 冰和
浓硫酸。
②再向三口烧瓶中慢慢加入 苯磺酰氯,尽快地分次加入
锌粉,继续反应
,温度保持在
左右,如图1。
③撤去水浴B,微热三口烧瓶,并保持一定的回流。反应平稳后,再加热 。
④将反应后的混合液进行水蒸气蒸馏,分出苯硫酚,如图2。
⑤加入氯化钙,经操作X得粗品 。再进行蒸馏,收集馏分,得纯品
。
回答下列问题:
a.冰盐水浴 b.冷水浴 c.热水浴

②除去过量H2O2溶液的目的是;
③由FeC2O4·2H2O沉淀、K2C2O4溶液、H2O2溶液、H2C2O4溶液制备 溶液的化学反应方程式。

某同学在实验室中根据2SO2(g)+O2(g)2SO3(g),设计如图1所示实验装置来制备SO3固体。

①在A装置中加入Na2SO3固体的同时,还需加几滴水,然后再滴加浓硫酸。加几滴水的作用是。
②装置D盛放的是溶液,其作用是。
③实验开始时的操作顺序为。
a.先点燃E处的酒精灯后将混合气体通入E
b.先将混合气体通入E后点燃E处的酒精灯
图2是实验室制乙烯的发生装置,根据图示回答下列问题:

图2中仪器①、②的名称分别为。
为检验上述实验收集到的产物,该小组同学进行了如表实验并得出相应结论。
实验序号 | 检验试剂和反应条件 | 现象 | 结论 |
① | 酸性KMnO4溶液 | 紫红色褪去 | 产物含有乙烯 |
② | 澄清Ca(OH)2溶液. | 变浑浊 | 产物含有CO2 |
③ | 通过品红溶液 | 红色褪去 | 产物含有SO2 |
实验①~③中的结论不合理的是(填序号),原因是。
 ,相对分子质量170)是治疗贫血药物的一种。实验制备富马酸亚铁并测其产品中富马酸亚铁的质量分数。
,相对分子质量170)是治疗贫血药物的一种。实验制备富马酸亚铁并测其产品中富马酸亚铁的质量分数。
 ),在90~100℃条件下持续加热2~3h。
),在90~100℃条件下持续加热2~3h。
装有糠醛的仪器名称是;仪器A的作用是,出水口为(填“a”或“b”)。
步骤1:将4.64g富马酸置于100mL烧杯中,加水20mL在热沸搅拌下,加入适量Na2CO3溶液调节溶液的pH;
步骤2:将上述溶液转移至如图乙所示的装置中(夹持仪器已略去),缓慢加入40mL2mol/LFeSO4溶液,维持温度100℃,持续通入氮气,充分搅拌1.5h;

步骤3:冷却、过滤,洗涤沉淀,然后水浴干燥,得到产品。
步骤1中所加Na2CO3溶液需适量的原因是。