实验室制 | 实验室收集 | 验证 | 除去 |
|
|
|
|
| | | |
|
|
|
|
A.过滤 | B.排空气法收集 | C.混合浓硫酸和乙醇 | D.溶液的转移 |

| 气体 | 试剂 | 制备装置 | 收集方法 | |
| A | O2 | KMnO4 | a | d |
| B | H2 | Zn+稀H2SO4 | b | e |
| C | NO | Cu+稀HNO3 | b | c |
| D | CO2 | CaCO3+稀H2SO4 | b | c |
 B .
B .  C .
C .  D .
D . 





选项 | 化学试剂 | 制备的气体 |
A | C2H5OH+ H2SO4 (浓) | C2H4 |
B | MnO2+HCl(浓) | Cl2 |
C | MnO2 + H2O2 | O2 |
D | CaO+氨水(浓) | NH3 |
| | | | |
| A.检验1-溴丙烷和氢氧化钠的醇溶液反应生成丙烯 | B.观察铁的吸氧腐蚀 | C.收集氨气 | D.仪器中液体体积为 |

 B . 比较Ksp( AgCl)和Ksp(AgI )的大小
B . 比较Ksp( AgCl)和Ksp(AgI )的大小  C . 制备并收集干燥的NH3
C . 制备并收集干燥的NH3  D . 制取和收集少量CO2、NO和O2
D . 制取和收集少量CO2、NO和O2 
| 验证溴乙烷消去反应的气体产物为乙烯 | 实验室制乙酸乙酯 | 收集NO2气体 | 酸性:碳酸>苯酚 |
| | | | |
| A | B | C | D |



选项 | A | B | C | D |
方案 |
|
|
|
|
目的 | 收集乙烯并验证它与溴水发生加成反应 | 探究苯分子中是否含有碳碳双键 | 在强光照条件下制取纯净的一氯甲烷 | 实验室制备乙酸乙酯 |

|
性质 |
颜色、状态 |
熔点 |
特性 |
|
具体描述 |
常温下为棕色固体 |
1195 |
空气中会被氧化,遇水强烈水解,产生刺激性气味气体 |
工业上利用单质钙在氮气流中,控制温度450℃,可制得氮化钙。实验室模拟工业制备氮化钙,并对氮化钙纯度进行测定,实验方案如下:

A处产生 , 请写出A中反应的化学方程式。工业上一般采用(填具体做法)制取
。
方案一:称取氮化钙样品2.4g,按图1所示装置进行实验,发现B装置增重0.51g。

该样品中氮化钙的质量分数为。
方案二:取与方案一同质量的样品,改用图2装置进行纯度测定,倾斜Y型管,将蒸馏水倒入样品管中,充分反应后测量气体体积。
方案二测得的氮化钙纯度为95%左右,试分析方案一测得的氮化钙纯度偏低的原因。

①图中三套装置中能制备干燥NH3的是(填“甲”或“乙”或“丙”)。
②上述方案中制备NH3的化学方程式是。
③检验NH3是否收集满的方法是。

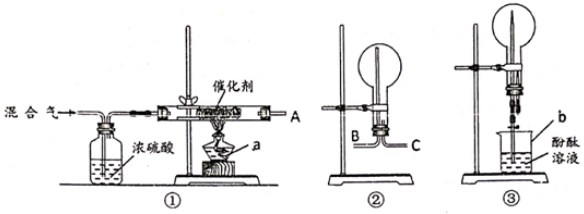
用图中装置进行实验,一段时间后,A中硬质玻璃管内黑色粉末变为红色,B中固体变蓝色,C中出气导管处收集到一种无色无味的气体单质。
①仪器B的名称;
②A中硬质玻璃管内发生反应的化学方程式。
③洗气瓶中浓硫酸的作用为。
④有同学提出,A中红色产物中可能含有Cu2O(已知:Cu2O+2H+=Cu2++Cu+H2O),请设计实验方案验证:。
仪器A的名称是。
将缓慢倾入
溶液中,搅拌后发生反应:
, 列式计算说明该反应进行较为完全的原因:。已知:该反应温度下,
、
;一般认为
时反应进行较完全,
时反应难以进行。
|
实验操作 |
实验现象 |
原因解释 |
|
ⅰ.取少量待测 |
溶液出现黄色浑浊,有刺激性气味气体产生。 |
用离子方程式解释实验现象: |
|
ⅱ.静置,取上层清液滴加适量。 |
。 |
待测液中含有 |
Ⅲ.定影原理探究

实验步骤:
①组装仪器,检查装置气密性;
②加入试剂,关闭旋塞E,加热A;
③将铜丝上提离开液面,停止加热。

| 选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
| A | 浓氨水 | CaO | NH3 | H2O |
| B | 浓盐酸 | KMnO4 | Cl2 | NaOH溶液 |
| C | 稀硝酸 | Cu | NO2 | H2O |
| D | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |


请回答下列问题:
(实验目的)探究 金属的成分
猜想2:M的成分是铁和铝;
猜想3:M的成分是;
猜想4:M的成分是铁、铜和铝

完成实验目的和猜想填空内容。
若该实验需要0.50mol/LNaOH溶液240mL,用规格仪器配制时应称量g NaOH(用托盘天平),若称量的NaOH固体中混有Na2O杂质会导致所配溶液浓度(填“偏大”、“偏小”或“无影响”)


试回答: