 B . 收集CO2
B . 收集CO2  C . 滤去CaCO3
C . 滤去CaCO3  D . 制得CaCl2﹒6H2O
D . 制得CaCl2﹒6H2O 
 定容
B .
定容
B .  制备氧气
C .
制备氧气
C .  制备乙酸乙酯
D .
制备乙酸乙酯
D .  实验室制硝基苯
实验室制硝基苯
 B . 制取氯气
B . 制取氯气  C . 除去CO2中的SO2
C . 除去CO2中的SO2 D . 制取蒸馏水
D . 制取蒸馏水 

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓硝酸 | Cu | NO2 | NaOH溶液 |
B | 浓氨水 | CaO | NH3 | H2O |
C | 稀硝酸 | Cu | NO | H2O |
D | 浓硫酸 | Cu | SO2 | 饱和NaHSO3溶液 |



气体 | 试剂 | 制备装置 | 收集方法 | |
A | CO2 | 石灰石+稀H2SO4 | c | d |
B | NH3 | NH4Cl+Ca(OH)2 | b | f |
C | SO2 | Na2SO3+浓H2SO4 | c | e |
D | Cl2 | MnO2+浓盐酸 | a | d |




气体 | 制备试剂 | 除杂试剂 | 所选装置 | |
A | SO2 | Cu+浓H2SO4 | 饱和NaHSO3溶液 | b、c |
B | Cl2 | MnO2+浓HCl | 饱和NaCl溶液 | b、c |
C | C2H4 | C2H5OH+浓H2SO4 | KMnO4溶液 | b、c |
D | C2H2 | 电石+饱和NaCl溶液 | CuSO4溶液 | a、c |
选项 | A | B | C | D |
实验目的 | 制备Cl2 | 制备并收集NO | 配制0.10 | 检验CO2中混有的CH4 |
实验试剂 | 浓盐酸和二氧化锰 | Cu和稀硝酸 | 水和NaOH(s) | I中澄清石灰水,II中溴水 |
实验装置 |
|
|
|
|
 B . 乙烯
B . 乙烯  C . 乙酸乙酯
C . 乙酸乙酯  D . 氢气
D . 氢气 

索氏提取装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与茶叶末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对茶叶末的连续萃取。回答下列问题:
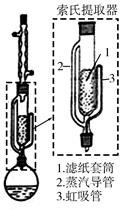
A.直形冷凝管 B.球形冷凝管C.接收瓶D.烧杯


步骤 | 现象 |
将一小块金属钠在燃烧匙中点燃,迅速伸入盛有CO2的集气瓶中。充分反应,放置冷却 | 产生大量白烟,集气瓶底部有黑色固体产生,瓶壁上有白色物质产生 |
在集气瓶中加入适量蒸馏水,振荡、过滤 | 滤纸上留下黑色固体,滤液为无色溶液 |
①为检验集气瓶瓶壁上白色物质的成分,取适量滤液于2支试管中,向一支试管中滴加1滴酚酞溶液,溶液变红:向第二支试管中滴加澄清石灰水,溶液变浑浊。据此推断,白色物质的主要成分是(填标号)。
A.Na2O B.Na2O2 C.NaOH D.Na2CO3
②为检验黑色固体的成分,将其与浓硫酸反应,生成的气体具有刺激性气味。据此推断黑色固体是。
③本实验中金属钠与二氧化碳反应的化学方程式为。
氨气的制备
①氨气的发生装置可以选择上图中的,反应的化学方程式为.
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→(按气流方向,用小写字母表示).
氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好).在一定温度下按图示装置进行实验.

操作步骤 | 实验现象 | 解释原因 |
打开K1 , 推动注射器活塞,使X中的气体缓慢充入Y管中 | ①Y管中 | ②反应的化学方程式 |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
打开K2 | ③ | ④ |

甘氨酸(H2NCH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
I.配制含0.10mol FeSO4的绿矾溶液。
II.制备FeCO3: 向配制好的绿矾溶液中,缓慢加入200mL 1.1mol/LNH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
III.制备(H2NCH2COO)2Fe: 实验装置如下图(夹持和加热仪器已省略),将实验II 得到的沉淀和含0.20mol 甘氨酸的水溶液混合后加入C 中,然后利用A 中反应产生的气体将C 中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。

回答下列问题:
①检查装置A 的气密性的方法是。
②装置A 中所盛放的药品是 (填序号)。
a.Na2CO3 和稀H2SO4
b.CaCO3 和稀H2SO4
c.CaCO3 和稀盐酸
③确认c 中空气排尽的实验现象是。
④加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是。
⑤洗涤实验III中得到的沉淀,所选用的最佳洗涤试剂是 (填序号)。
a.热水
b.乙醇溶液
c.柠檬酸溶液
⑥若产品的质量为17.34g,则产率为。


①液体石蜡鼓泡瓶的作用是 。
②若无冰水,则氨基甲酸铁易分解生成尿素[CO(NH)2]2请写出氨基甲酸铵受热分解的化学方程式:。
③当CCl4液体中产生较多晶体悬浮物时,立即停止反应,过滤分离得到粗产品,为了将所得粗产品干燥,可采取的方法是(填字母)。
A.蒸馏
B.真空微热烘干
C.高压加热烘干
①设计方案进行成分探究,请填写表中空格。
限选试剂:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸。
实验步骤 | 预期现象和结论 |
步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解 | 得到无色溶液 |
步骤2:向试管中加入过量的BaCl2溶液,静置 | 若溶液不变浑浊,则证明固体中不含碳酸铵 |
步骤3:向试管中继续加入 | , 则证明固体中含有碳酸氢铵 |
②根据①的结论,取15.8g氨基甲酸氨样品,用足量氢氧化钡溶液充分处理后,过滤洗涤、干燥测得沉淀质量为1.97g。则样品中氨基甲酸铵的质量分数为。


a.C2H4 b.NO2 c.H2 d.Cl2 e.CO2 .
实验可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水.

请回答:
→→→⑥→⑦→→→
a.视线与凹液面最低处相平
b.等待气体恢复常温才读数
c.读数时应上下移动乙管,使甲乙两管液面相平
d.读数时不一定使甲乙两管液面相平
硝酸在工业及科研上常用于物质的制备.实验室常用稀硝酸与铜反应制取干燥且较纯的一氧化氮,现设计如下实验.按下图连接好装置并检查气密性,在A中加入0.5g碳酸钙粉末,再加入20.0mL 5.0mol•L﹣1的稀硝酸,片刻后塞上胶塞,将铜丝插入稀硝酸中. 
① ②
已知:;
在300℃以上完全分解产生两种单质。
下表是几种物质的熔沸点:
物质 | S | CS2 | |||
熔点/℃ | 112.8 | -109 | -23 | -77 | -121 |
沸点/℃ | 444.6 | 47 | 77 | 137 | 59.6 |
某实验小组利用以下装置制备 , 回答下列问题:



①如果选用A装置作为氨气的发生装置,则反应的化学方程式为:。
②选择上图中的装置,欲收集一瓶干燥的氨气,装置的使用顺序为A→→→ → (按气流方向,用大写字母表示)。

①先打开旋塞1,B瓶中的现象是,原因是。
②稍后关闭旋塞1,再打开旋塞2,B瓶中的现象是。

A.稀释浓硫酸时,未冷却至室温即转入容量瓶进行定容
B.用量筒量取浓硫酸时俯视刻度线
C.定容时俯视容量瓶刻度线
D.转移溶液时未洗涤烧杯

①仪器m的名称为。
②装置连接顺序:A→→E→D。
③A中发生反应的离子方程式为。
④装置F的作用是。
⑤D中的最佳试剂是(填标号)。
a.碱石灰 b.浓硫酸 c.无水氯化钙
⑥为了提高S2Cl2的纯度,关键的是控制好温度和。

①W溶液可以是下列溶液中的(填标号);
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中二氧化硫的体积分数为(含V、m的代数式表示)。
|
熔点/℃ |
沸点/℃ |
其他 |
|
|
PCl3 |
-112 |
75.5 |
遇水生成H3PO3和HCl |
|
POCl3 |
2 |
105.3 |
遇水生成H3PO4和HCl |
某兴趣小组模拟该工艺设计实验装置如图(某些夹持装置、加热装置已略去):

①先制取Cl2 , 缓慢地通入C中,直至C中的白磷消失后,再通入O2。
②C装置用水浴加热控制温度为60~65℃,除加快反应速率外,另一目的是。
③反应物必须干燥,否则会在C装置中产生大量的白雾,其主要成分为 (写化学式)。
用下图装置加热 固体,试管内有红棕色气体生成,一段时间后,在末端导管用小试管收集到无色气体a。

实验室检验气体a的方法为。

甲同学认为试管②中产生银镜是 所致,其离子方程式为。


①制备NO发生装置可以选用(填写字母代号),请写出发生反应的离子方程式:。
②欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→ (按气流方向,用小写字母表示)。

①实验室也可用X装置制备NO,X装置的优点为。
②检验装置气密性并装入药品,打开K2 , 然后再打开 ,通入一段时间气体,其目的为,然后进行其他操作,当Z有一定量液体生成时,停止实验。
③若无装置Y,则Z中NOCl可能发生反应的化学方程式为。
④若尾气处理装置连接上图烧杯中导管d,则烧杯中可加入 溶液。