
化学键 | O-H | H-H | O-O |
键能kJ·mol-1 | 463 | 436 | 498.3 |
温度 | 衡时 | ||||
450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
选项 | 实验操作和现象 | 结论 |
A | 室温下,将BaSO4投入饱和Na2CO3溶液中充分反应,向过滤后所得固体中加入足量盐酸,固体部分溶解,有无色无味气体产生 | |
B | 向2.0 mL浓度均为0.1 mol/LNaCl和NaI的混合溶液中滴加2滴0.1 mol/L AgNO3溶液,振荡,沉淀呈黄色 | |
C | 向10 mL0.2 mol/LNaOH溶液中滴入2滴0.1 mol/LMgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/L FeCl3溶液,有红褐色沉淀生成 | |
D | 在2 mL0.01 mol/LNa2S溶液中先滴入几滴0.01 mol/L ZnSO4溶液,有白色沉淀生成,再滴入0.01 mol/L CuSO4溶液,又出现黑色沉淀 |

反应I.
反应II.
压强分别为、
时,将
的混合气体置于密闭容器中反应,不同温度下体系中
的平衡转化率和
、CO的选择性如图所示。
(或CO)的选择性

下列说法正确的是
C(s)+O2(g)=CO2(g) △H1=-393.5 kJ·mol-1①
H2(g)+O2(g)=H2O(g) △H2=-242.0kJ·mol-1②
CO(g)+O2(g)=CO2(g) △H3=-283.0kJ·mol-1③
甲同学据此认为:“煤炭燃烧时加少量水,可以使煤炭燃烧放出更多的热量。”乙同学根据盖斯定律作出了下列循环图:

请你写出△H1、△H2、△H3、△H4之间存在的关系式:。
乙同学据此认为:“将煤转化为水煤气再燃烧放出的热量,最多与直接燃烧煤放出的热量相同。”请分析:甲、乙两同学观点正确的是(填“甲”或“乙”)同学,另一同学出现不正确观点的原因是。

实验序号 | A溶液 | B溶液 |
① | 20 mL 0.01 mol·L | 30 mL 0.01 mol·L |
② | 20 mL 0.01 mol·L | 30 mL 0.01 mol·L |
完成上述反应的离子方程式为: , 该实验是探究对反应速率的影响。

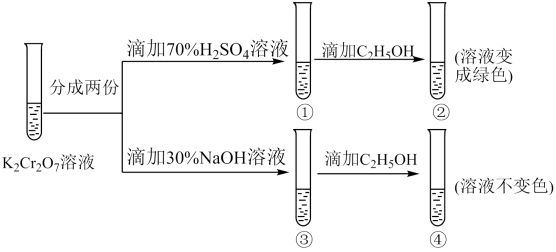
向溶液中加入30%NaOH溶液。溶液呈色:向
溶液中逐滴加入
溶液(已知
为黄色沉淀),则平衡向着方向移动,溶液颜色变化为。
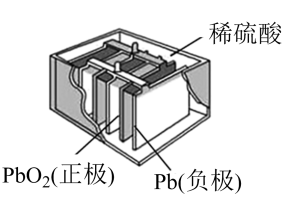
负极;正极。
一些难溶电解质的溶度积常数如下表:
难溶电解质 | ||||
一定条件下,一些金属氢氧化物沉淀时的pH如下表:
金属氢氧化物 | ||||
开始沉淀的pH | 2.3 | 6.8 | 3.5 | 7.2 |
完全沉淀的pH | 3.2 | 8.3 | 4.6 | 9.1 |
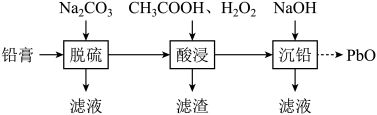
回答下列问题:
在“脱硫”中转化反应的离子方程式为;
饱和溶液中
。
①能被氧化的离子是;
②促进了金属Pb在醋酸中转化为
, 其化学方程式为。
③也能使
转化为
,
的作用是。
离子交换膜法电解饱和食盐水原理示意图如图1。

①气体a的电子式为:。
②结合电极反应式解释阴极区得到溶液的原因。
采用无隔膜电解槽,电解3%~5%的溶液,可制备
溶液。控制较低温度,适宜电压电解制备
溶液原理示意图如图2。

已知:与次氯酸盐相比,次氯酸具有更强的氧化性。
电解食盐水制备溶液总反应的化学方程式为。
①过高,阳极会发生
放电,导致电解效率降低,电极反应为。
②过低,产生影响的可能原因:
假设过低时,导致
溶解度,生成的
减少。
假设过低时,
浓度增大氧化
, 生成
和
。
I.查阅文献,假设b成立。相应反应的离子方程式为。
Ⅱ.若通过检测反应前后溶液酸性的变化证实假设b成立,实验操作和现象为:取溶液,。可供选择的试剂和仪器:a.稀硫酸| b.稀盐酸| c.石蕊溶液 d.
计