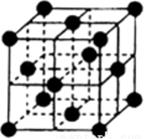
| W |
|
| X | Y |
Ga | Z |
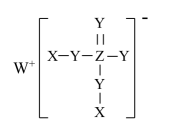

元素 | X | Y | Z | W | T |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
主要化合价 | +2 | +3 | +6、-2 | -1 | -1 |
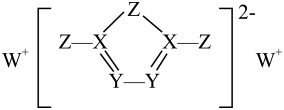
下列有关说法正确的是

下列叙述正确的是


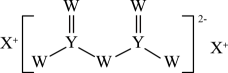
请回答下列问题:
①NH3和H2O②和H3O+③NH3和H3O+④O3 和SO2⑤CO2 和BeCl2⑥
、
和
⑦BF3和AI2Cl6

试回答下列问题。
元素 | o | p | |
电离能kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态基态o2+再失去一个电子比气态基态p2+再失去一个电子难。对此,你的解释是。


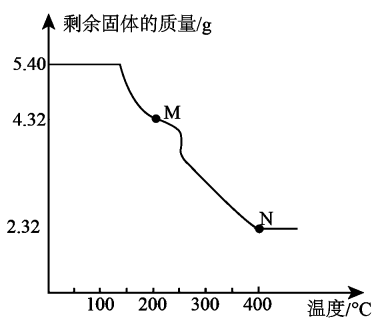
根据上述信息回答下列问题:

根据判断出的元素回答下列问题:

①钛网与直流电源的极相连;
②石墨电极的电极反应式为;
③写出生成葡萄糖酸的化学反应方程式:。

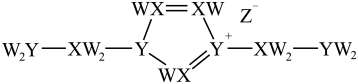
已知:X、Y、Z、W属于原子序数递增的短周期元素,Z核外最外层电子数是电子层数的3倍。
①TCCA的分子式是。
②X、Y、Z对应简单氢化物中热稳定性最强的是(用氢化物的化学式表示)。
资料:NaClO2晶体易溶于水,难溶于乙醇。NaClO2饱和溶液在温度低于38 ℃时析出NaClO2·3H2O晶体,高于38 ℃时析出NaClO2晶体,高于60 ℃时NaClO2分解成NaClO3和NaCl。
① 写出由ClO2制备NaClO2的离子方程式。
② 从上述NaClO2溶液获得干燥的NaClO2晶体的操作步骤为:将溶液在减压和55 ℃条件下蒸发至大量晶体析出后,,,低于60℃干燥,得到NaClO2晶体 (补全实验步骤)。
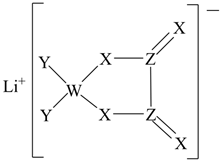
①B2A2中的所有原子都满足8电子稳定结构
②每个B2A2分子中σ键和π键数目比为1:1
③B2A2是含极性键和非极性键的非极性分子
④B2A2中心原子的杂化类型为sp杂化
①离子键 ②共价键 ③氢键 ④配位键 ⑤金属键