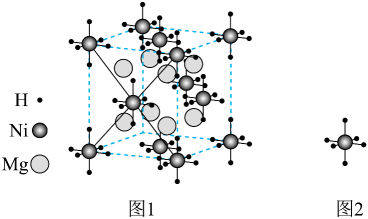

下列说法不正确的是( )
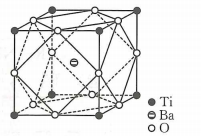



A | B | C | D |
|
|
|
|
金刚石晶体中,每个碳原子被12个六元环共用 | | 干冰熔化或升华时, | |
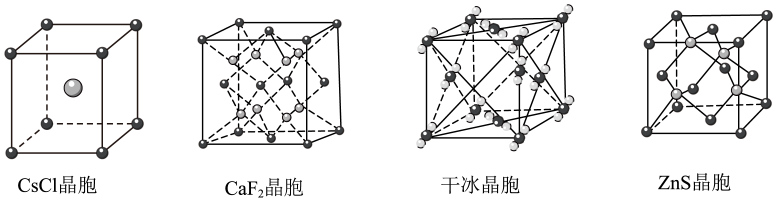





下列说法中不正确的是( )
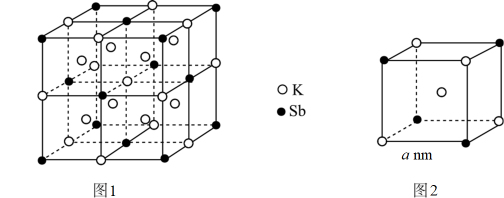



下列说法不正确的是____。


化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
熔点/℃ | 377 | -24.12 | 38.3 | 155 |


a.几何因素 b.电荷因素 c.键性因素
①单晶硅属于晶体。
②熔点比较:单晶硅金刚石。(选填>、<、=)
①CO2分子的空间结构为,在干冰晶体中每个CO2周围等距且紧邻的CO2有个。
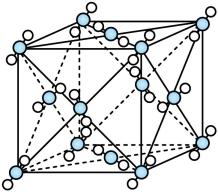
②CH3OH和CO2分子中σ键数目之比为。
③CH3OH比CO2在水中的溶解度大,这是因为。
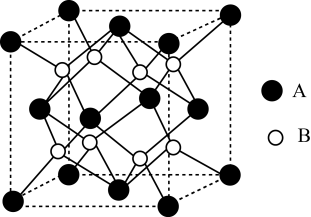
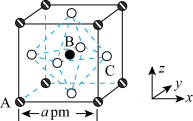
①B代表(填“”或“
”)。
②ZrO2晶胞的棱长分别为anm、anm、cnm,其晶体密度为(列算式用
表示阿伏加德罗常数的值)。
电离能/( | | | | | …… |
Fe | 759 | 1561 | 2597 | 5290 | …… |
则,铁的第四电离能()大于第三电离能(
)的可能原因是:。


 ,此配离子内部不含有的化学键类型是____。
,此配离子内部不含有的化学键类型是____。
由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体的晶胞如图所示,X晶体的化学式为:


