(资料):
①K2MnO4水溶液呈墨绿色,在水及酸性条件下会发生歧化反应,生成KMnO4和MnO2 .
②在 K2CO3溶液中持续通入 CO2 , 会生成 KHCO3 .
③室温时,K2CO3、KHCO3、KMnO4的溶解度分别为 111g、33.7g、6.36g.


①为使、
除尽,必须保持溶液中
。
②若调节溶液的偏低、将会导致
、
沉淀不完全,其原因是。[已知
,
,
]。

①该工艺中设计萃取、反萃取的目的是。
②萃取率随
升高先增大后减小的可能原因是。
①点剩余固体产物为。(写出计算过程)
②钴的一种氧化物的晶胞(构成晶体的最小结构单元)如题47图-3所示,在该晶体中与一个钴原子等距离且最近的钴原子有个。

②向CoSO4溶液中加入足量锌粉,观察到的现象是。

反应过程中有气体产生,气体的成分为(填化学式),并请在图中补充完善反应后溶液中含有的粒子种类(粒子数目不作要求,不考虑水)。

已知300℃以上残留的固体全部为钴的氧化物,BC段空气中的氧气参与了反应,生成的气体均为CO2 , 请计算BC段参与反应的氧气质量为g。

已知:
①物质溶解性:难溶于水,
难溶于水;
② , Li与碱溶液不发生反应;
③ , 氯气是一种有毒的气体;
④部分金属离子形成氢氧化物沉淀的pH见下表。
金属离子 | Fe3+ | Co2+ | Co3+ | Al3+ |
pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
农业上用硫酸铜、生石灰加水混合配制常用的杀菌剂波尔多液,但不能用铁制容器配制,原因是(用化学方程式解释)。
【查阅资料】制备硫酸铜的一种方案:Cu+H2O2+H2SO4=CuSO4+2H2O。
【进行实验】将反应物装入烧杯中,观察到如下现象:开始时有少量气泡,后来反应剧烈产生大量气泡,放出热量,溶液呈蓝色,该溶液即为硫酸铜溶液。
【提出疑问】实验中为什么有气体生成?同学们进行了如下探究。
项目四:实验异常现象探究
【查阅资料】制备硫酸铜过程中,H2O2发生了分解反应,生成的气体是
【提出问题】什么因素加快了H2O2分解?
【猜想与假设】
猜想一:生成的CuSO4;
猜想二:温度升高;
猜想三:。

【实验分析】
实验观察到的现象:实验一产生气泡;实验二无明显现象;实验三产生气泡;实验四快速产生气泡,对比实验一和实验二可以得出的结论是。为了验证温度升高能加快H2O2的分解,甲同学的方案是实验二和实验三对比;乙同学的方案是实验一和实验四对比。你认为同学的方案更严谨,理由是。
【实验结论】猜想三正确。


①图2中“防倒吸装置”应选择(选填“甲”或“乙”)。
②水的作用是。
红磷燃烧的现象是,该反应的化学方程式为。
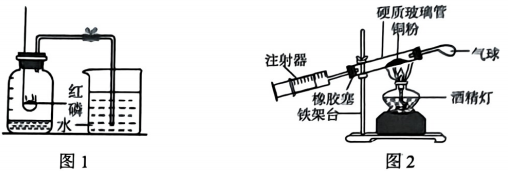
查阅资料:铜与氧气在加热的条件下,反应生成氧化铜固体。
同学们记录的实验数据如下:硬质玻璃管中空气的体积为44mL,反应前注射器中的刻度为36mL,反应后注射器中的刻度为24mL,计算实验测得空气中氧气的体积分数为。实验测得的结果与理论值有较大偏差,可能的原因是。

①图3所示装置中电烙铁的作用是。
②图4中Y曲线表示(填“压强”“温度”或“氧气浓度”)的变化趋势。
③下列说法正确的是(填字母序号)。
a.实验装置(如图3)中的氧气并没有被红磷完全消耗
b.图4中X曲线AB段变化原因是红磷燃烧放热导致瓶内气压增大
c.图3与图1的实验装置对比,图3的装置更环保,测量数据更精准
【提出问题】M、铜、铝的金属活动性顺序是怎样的?
【猜想与假设】
【设计实验一】
小敏取M丝、铜丝、铝丝和编号为Ⅰ、Ⅱ、Ⅲ的3支试管(试管中均盛有体积相同、浓度也相同的稀盐酸),进行如表的实验:
实验操作 | M丝插入试管Ⅰ | 铜丝插入试管Ⅱ | 铝丝插入试管Ⅲ | 结论 |
刚开始的现象 | 少量气泡产生 | 无气泡 |
| |
几分钟后的现象 | 少量气泡产生 | 无气泡 | 有大量气泡产生 |
同学们对同一实验得出两种不同结论的现象进行了讨论,明白了实验刚开始时试管Ⅲ中无气泡产生的原因,其原因是。
为了进一步探究三种金属的活动性顺序,同学们取粗细相同,打磨干净的M丝、铝丝及相关溶液,进行如下图中的实验:

试管乙中观察到的现象是。
同学们经讨论后认为该实验可以优化,去掉试管(填“甲”“乙”或“丙”)中的实验,也可以得出三种金属的活动性强弱的结论。
【评价与反思】
实验结束后,同学们对实验过程进行了如下反思:探究金属活动性顺序时,除了上述实验中已经用到的两种方法外,还可以根据进行判断。
【提出问题】
该气体的成分是什么?
【提出猜想】
猜想二:该气体是。
猜想三:该气体是SO2和CO2。
①SO2能与酸性高锰酸钾溶液反应,使其褪色。
②SO2也能使澄清石灰水变浑浊。
【实验设计】
装置如图所示:

【现象与分析】
装置B中酸性高锰酸钾溶液颜色变浅,说明气体中含有。
猜想三成立。
【反思交流】
若装置B与装置C位置互换,判断该实验设计是否合理并说明理由:。
【查阅资料】①草酸化学式为H2C2O4;草酸在一定条件下会分解成多种氧化物。②氢氧化钠溶液能吸收二氧化碳;浓硫酸具有吸水性,可作干燥剂。
【提出问题】
草酸分解的生成物有哪些?
猜想①:该气体是。
猜想②:该气体是CO。
猜想③:该气体是CO2和CO。
依据CO2和CO的性质,兴趣小组同学设计了如下实验:

【实验探究】
观察到A装置中的澄清石灰水变浑浊,发生反应的化学方程式为,证明有气体。
①C装置中澄清石灰水不变浑浊,F装置中。
②E装置中出现的现象。
通过实验探究证明:草酸分解的化学方程式为。
【问题讨论】
B装置的作用是,D装置的作用是。
探究一:草酸受热分解的产物
【提出猜想】三种氧化物可能是和
【查阅资料】①草酸晶体以上分解;②草酸的钙盐难溶于水;③
不与
反应;④
通入
溶液中有黑色沉淀
和
生成;⑤白色无水
粉末遇水变蓝色。
【实验方案】如题图所示,取研细的草酸晶体装入试管,加热,检验气体。

为了使实验更严谨、更严密,有同学认为该实验应该在装置之间加盛有澄清石灰水的试管,其作用为。
探究二:草酸钙受热分解的定量测定

对草酸钙晶体进行热分解,绘制固体质量一分解温度的关系如题图所示。经测定,固体质量
时,为
。
加热至时,开始生成一种有毒气体,该气体的名称是。
以上时,固体成分的化学式为。
【查阅资料】①CO与氯化钯(PdCl2)溶液反应生成黑色沉淀,可用于检验CO,反应原理可用化学方程式表示为:PdCl2+CO+H2O=Pd↓+CO2+2HCl;
②浓硫酸可吸水,氢氧化钠溶液可吸收CO2。

兴趣小组设计实验测定某只含铁、氧两种元素的固体样品中铁、氧原子个数比,实验装置如图所示(假设每步反应均完全):

用文字描述装置C中发生反应的原理。
装置 | D和E |
反应前质量 | 492.4g |
反应后质量 | 505.6g |
同学对草酸产生了兴趣,经请教老师获知,草酸(H2C2O4)在通常状况下为固体,是一种易溶于水的酸,广泛存在于植物源食品中。草酸固体在浓硫酸的催化作用下,受热分解生成碳的氧化物和水,小组同学对生成物中碳的氧化物的种类进行了如下探究。
【提出问题】生成物中有哪几种碳的氧化物?

①为了实验安全,在实验开始时应该先通一会儿气体,再点燃酒精灯,目的是。
②实验时,当观察到装置A中的现象为,说明草酸的分解产物中有CO2气体存在。
③实验时,当观察到C中现象为,说明草酸分解产物中有CO气体存在,该反应的化学方程式为。
通过实验,可得到的结论是,猜想3正确。请写出草酸(H2C2O4)在浓硫酸的催化下,受热分解的化学方程式。
装置D的作用是检验生成的二氧化碳并。
①实验室常用过氧化氢溶液与二氧化锰混合制取氧气,该反应的化学方程式为。
②若用该方法制取并收集一瓶干燥的氧气,图甲装置接口的正确连接顺序依次为(填字母序号).
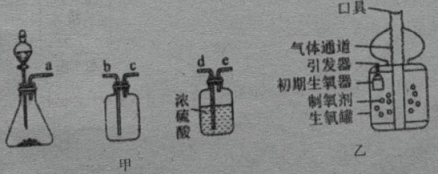
某市售“简易供氧器”主要由“初期生氧器”和“生氧罐”两部分组成,如图乙所示:兴趣小组的同学启动“初期生氧器”一段时间后,用磁铁靠近“初期生氧器”中的剩余固体,有黑色固体物质被吸引。于是,他们针对被吸引的黑色固体物质的成分开展探究。
【查阅资料】
①“简易供氧器”在工作初期,内部独立的“初期生氧器”首先启动,以解决初期供氧不足的问题,“初期生氧器”内有氯酸钾、二氧化锰、铁粉等物质。
②氯酸钾制取氧气的化学方程式为
③与硫酸反应的化学方程式为
④、
在溶液中分别呈黄色和浅绿色。
【提出问题】黑色固体物质的成分是什么?
【作出假设】猜想一:铁粉:猜想二:①;猜想三:四氧化三铁
实验操作 | 实验现象 | 得出结论 |
操作一:取被磁铁吸引的黑色固体物质干试管中,向其中加入足量的硫酸铜溶液,过滤 | 滤渣中有②色固体 | 黑色固体物质中一定含有铁粉 |
操作二:取被磁铁吸引的黑色固体物质于试管中,向其中加入足量的稀硫酸 | 固体完全溶解,得到澄清的黄色液体 | 黑色固体物质中一定含有③ |
“初期生氧器”中铁粉与氧气反应能(填“吸收热量”或“放出热量”),从而使氯酸钾的分解反应能持续进行。
【查阅资料】白磷的着火点是40℃,红磷的着火点240℃;P2O5能溶于水,有毒性。
【实验用品】药品:白磷、红磷、80℃热水;仪器:漏斗、橡胶导管、铁丝隔网等。
【实验装置】如图组装装置(夹持仪器已略去)。

实验步骤及操作 | 实验现象 |
Ⅰ.将一定量的白磷、红磷分别浸入80℃热水中 | 白磷、红磷均不燃烧。 |
Ⅱ.升高右侧漏斗至红磷露出水面 | |
Ⅲ. | 白磷燃烧、红磷不燃烧 |
【讨论交流】
实验步骤Ⅱ中的实验现象,实验步骤Ⅲ中的操作。
本实验存在的不足之处是。
实验中观察到图甲试管中的现象是。
观察到红磷不燃烧而白磷燃烧,说明可燃物发生燃烧应具备的条件是。