 B . 图B是高温灼烧一定质量的大理石
B . 图B是高温灼烧一定质量的大理石 C . 图C是将等质量的Mg、Fe分别与溶质质量分数相同的足量稀硫酸反应
C . 图C是将等质量的Mg、Fe分别与溶质质量分数相同的足量稀硫酸反应 D . 图D是向一定质量的HCl和MgCl2的混合溶液中,逐滴加入NaOH溶液
D . 图D是向一定质量的HCl和MgCl2的混合溶液中,逐滴加入NaOH溶液

选项 | 物质结构 | 性质 | 用途 |
A | 氢氧化钡中含有Ba2+ | 具有碱性 | 可以除去溶液中的SO42- |
B | 氢氧化钡中含有OH- | 具有碱性 | 可以除去溶液中的H+ |
C | 稀硫酸中含有H+ | 具有酸性 | 检验溶液中是否存在Ba2+ |
D | 稀硫酸中含有SO42- | 具有酸性 | 检验溶液中是否存在CO32- |


试剂 | 稀盐酸 | 食醋 | 蔗糖水 | 蒸馏水 | 肥皂水 | 烧碱溶液 | 石灰水 |
颜色 | 红 | 红 | 黄 | 黄 | 绿 | 绿 | 绿 |
请分析上表,并回答下列问题:


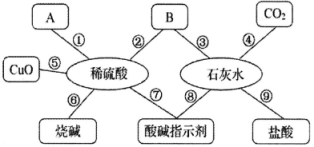

步骤1:向三支试管中分别滴加酚酞后,Na2CO3溶液中显红色,
说明Na2CO3溶液显性;
步骤2:小强把三支试管中的溶液同时倒入一只烧杯中,发现有气泡产生,最终有白色沉淀生成且溶液显红色;
步骤3:把烧杯中的混合物进行过滤,得到滤液,滤液中一定不含.
(选填答案:A、稀盐酸 B、澄清石灰水 C、碳酸钠溶液)
【实验猜想】步骤3所得滤液中溶质可能为:
①NaCl Na2CO3; ②NaCl CaCl2和NaOH; ③NaCl Na2CO3和NaOH; ④…
【实验验证】(提示:CaCl2溶液显中性)
|
实验操作 |
实验现象 |
实验结论 |
|
取少量滤液于试管中,加入足量CaCl2溶液 |
|
猜想③成立 |
【反思评价】有同学提出CaCl2溶液改为稀盐酸,若观察到有气泡产生且红色消失,则证明猜想③成立。小刚同学认为不正确,其理由是:。


Ⅱ.现代造纸:
【提出问题】黑液中除了有机物还有哪些成分呢?
【查阅资料】①黑液呈碱性,不能直接排放到水中。②BaCl2溶液呈中性。

【提出猜想】猜想一:NaOH;猜想二:Na2CO3;猜想三:NaOH和Na2CO3
【实验探究】该兴趣小组的同学设计了以下实验方案进行了探究
实验操作 | 实验现象 | 实验结论 |
步骤一:取样,向其中滴加过量BaCl2溶液 步骤二:将步骤一分应后的溶液静置,取少量上层清液于试管中,滴加2-3滴无色酚酞溶液 | 猜想三成立 |
【探秘干燥剂】
小明同学对一包久置的生石灰干燥剂成分(如图)进行如下探究:查阅资料:
①生石灰会吸收空气中的水分,生成氢氧化钙,氢氧化钙在500℃以上会分解为氧化钙和水。
②氢氧化钙与空气中的二氧化碳反应能生成碳酸钙,碳酸钙在900℃左右分解为二氧化碳和氧化钙。
【项目评价】
物质的检验有不同的方案,不同方案中所用试剂的量会影响检验的结果。为此他们设计了如下评价量表。
评价等级 | 优秀 | 合格 | 待改进 |
指标 | 有明显的实验现象,可用感觉器官直接判断 | 现象不是很明显,但可借助仪器判断 | 借助仪器也不能判断 |

表:常见植物最适宜的土壤酸碱度
|
【查阅资料】a.发热包内的粉末主要由生石灰、铝粉、铁粉、碳粉、氯化钠等组成。b.铝与酸溶液、碱溶液反应都能生成氢气。
【实验探究】小金为确定发热包的各种成分设计了实验方案进行实验,如下表。请将表格填写完整。
实验步骤 | 实验操作 | 实验结果 | 实验结论 |
一 | 取少量粉末,用磁铁靠近 | 其中有部分黑色粉末被磁铁吸引 | 成分中有铁 |
二 | 将磁铁充分吸附后的剩余粉末分成两份,其中一份加足量的水充分溶解后,过滤取滤液,测定其pH | pH大于7 | ①成分中存在 |
三 | 取少量滤液于试管中,② | 生成白色沉淀 | 成分中存在氯化钠 |
四 | 将步骤二得到的滤渣放入硬质玻璃管中加热,将产生的气体通入澄清石灰水 | 石灰水变浑浊,此过程发生的反应的化学方程式为③ | 成分中存在碳粉 |
五 | 将另一份粉末放入烧杯,加入适量NaOH溶液 | ④ | 成分中有铝粉 |
实验次数 | NaOH 质量/g | FeCl3溶液质量/g | Fe(OH)3质量/g |
1 | 12 | 200 | 10.7 |
2 | 24 | 200 | 21.4 |
3 | 48 | 300 | 32.1 |
4 | 60 | 400 | 42.8 |
根据实验结果回答下列问题:

①在加入少量白色固体的试管中滴加稀盐酸,观察到有气泡产生;
②在加入少量白色固体的试管中滴加氯化钙溶液观察到有沉淀产生;
③在加入少量白色固体和水的试管中,滴加酚酞可观察到溶液变红。
【定性探究】小科取其中一瓶氢氧化钠样品进行实验,实验过程及现象如图甲。

【定量实验】小丽取另一瓶氢氧化钠样品进行定量实验。将瓶中样品全部倒入烧杯中,加水充分溶解。逐滴加入溶质质量分数为7.3%的稀盐酸充分反应,当溶液的pH恰好为7时,所加稀盐酸的质量为100g。
解:设参加反应的碳酸钠质量为 | 设变质的氢氧化钠质量为 |
通过计算可知变质的氢氧化钠质量为8g,刚好与原有的8g氢氧化钠质量相等,所以氢氧化钠完全变质。 | |

加入盐酸的次数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
锥形瓶及所盛物质的总质量/克 | 76.4 | 101.4 | 126.4 | 151.4 | 174.2 | 197 | 222 | 247 |
请通过计算样品中碳酸钠的质量分数为多少。