②6CO2(g)+6H2O(g)=C6H12O6(s)+6O2 △H2
③2H2O(g)=2H2(g)+O2(g) △H3
④2CO2(g)+6H2(g)=C2H5OH(l)+3H2O △H4
下列有关说法正确的是( )

①光催化分解水制氧气:2H2O(l)=2H2(g) + O2(g) ΔH1=+571.6 kJ·mol-1
②过氧化氢分解制氧气:2H2O2(l)=2H2O(l) + O2(g) ΔH2=-196.4 kJ·mol-1
③一氧化氮分解制氧气:2NO(g)=N2(g) + O2(g) ΔH3=-180.5 kJ·mol-1
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1;CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2;
②S(s)+O2(g)═SO2(g)△H1;S(g)+O2(g)═SO2(g)△H2;
③2H2(g)+O2(g)═2H2O(l)△H1;H2(g)+ O2(g)═H2O(l)△H2;
④CaCO3(s)═CaO(s)+CO2(g)△H1;CaO(s)+H2O(l)═Ca(OH)2(s)△H2 .
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=Q1kJ•mol﹣1
又查资料得知:①CH3OH(l)+ O2(g)⇌CO2(g)+H2(g)△H=Q2kJ•mol﹣1
②H2O(g)=H2O(I)△H=Q3kJ•mol﹣1
则表示甲醇的燃烧热的热化学方程式为.
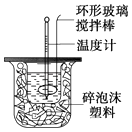
A.测量盐酸的温度后,温度计没有用水冲洗干净 B.做本实验的当天室温较高
C.将量筒中的NaOH(aq)倒入小烧杯时动作迟缓 D.在量取盐酸时仰视读数
E.大烧杯的盖板中间小孔太大.


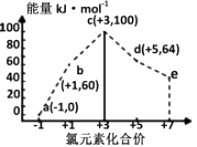
①p1p2(填“>”、“<”或“=”).
②在其他条件不变的情况下,向容器中再增加a mol CO与2a mol H2 , 达到新平衡时,CO的平衡转化率(填“增大”、“减小”或“不变”). 
③在p1下,100℃时,CO(g)+2H2(g)⇌CH3OH(g)反应的平衡常数为(用含a、V的代数式表示).
关于该反应的下列说法中,正确的是 (填编号).
①从反应开始到平衡,CO2的平均反应速率v(CO2)=.
②下列措施中能使化学平衡向正反应方向移动的是(填编号).
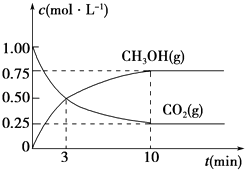
A.升高温度
B.将CH3OH(g)及时液化移出
C.选择高效催化剂
D.再充入1mol CO2和3mol H2 .
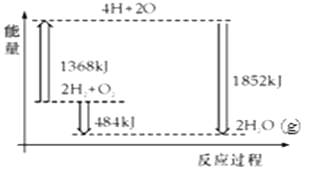
A.2H2(g)+O2(g)=2H2O(l)△H1
B.C(s)+1/2O2(g)=CO(g)△H2
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H3
D.C(s)+O2(g)=CO2(g)△H4
E.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H6
G.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H7
化学键 | P﹣P | P﹣O | O═O | P═O |
键能KJ/mol | 197 | 360 | 499 | a |
已知白磷(P4)的燃烧热为2378.0kJ/mol,白磷完全燃烧的产物(P4O10)的结构如图所示,则如表中a=.
