| A | B | C | D |
| 测量锌粒和3 mol/L硫酸反应生成H2的体积 | 制备并收集乙酸乙酯 | 加热熔融的纯碱固体 | 制取并收集SO2 |
| | | | |
| 实验目的 | 实验方案 | |
| A | 验证H2O2具有氧化性 | 向0.1 mol·L-1 KMnO4溶液中滴加0.1 mol·L-1H2O2溶液,可观察到溶液褪色 |
| B | 证明铜与浓硫酸反应有SO2生成 | 将浓硫酸滴加到放有铜片的试管中,并将蘸有品红溶液的湿滤纸置于试管口 |
| C | 比较Ksp(AgI)与Ksp(AgCl) 的大小关系 | 向浓度均为0.05mol·L-1的NaI、NaCl混合溶液中滴加足量AgNO3溶液,观察所产生沉淀的颜色 |
| D | 确定NaCl溶液中是否混有Na2CO3 | 取少量待测液,滴加CaCl2溶液,观察是否出现白色浑浊 |
| 选项 | 实验操作和现象 | 结论 |
| A | 向NaOH固体中加入少量稀盐酸,测得溶液温度高于室温 | 盐酸与氢氧化钠的反应为放热反应 |
| B | 向Na2SO3溶液中,加入BaCl2溶液,产生白色沉淀,过滤洗涤后,向所得沉淀中加入足量稀硝酸,沉淀不溶解 | 原Na2SO3溶液已变质 |
| C | 向pH=3的醋酸溶液中,加入醋酸铵溶液,溶液pH增大 | 醋酸铵溶液呈碱性 |
| D | 向含有少量CuCl2的MgCl2溶液中,滴加几滴氨水,产生蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| 实验 | 装置 | 试剂X | 现象 |
| ① | | 滴有酚酞的NaOH溶液 | 溶液红色褪色 |
| ② | NaHCO3溶液 | 产生气泡 | |
| ③ | HNO3酸化的AgNO3溶液 | 产生白色沉淀 | |
| ④ | FeCl2溶液、KSCN溶液 | 溶液变红 |


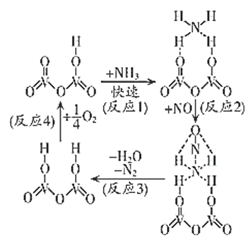
①“氧化1”中生成 ,其反应的离子方程式为。
②“还原”中溶液里含有 , 检验
的实验操作是。
③“吹碘”中通入热空气,利用了碘具有的性质。
已知反应: +5I-+6H+=3I2+3H2O,实验中可选用的试剂:2mol·L-1硫酸、1 mol·L-1KI溶液、淀粉溶液、CCl4。
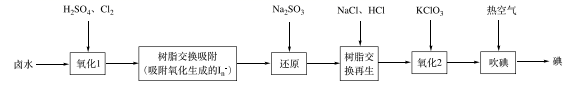
①取2.500L卤水样品减压浓缩至20.00mL,加入过量的0.1500mol·L-1CuCl2溶液20.00mL。
②密封静置2h,生成白色沉淀(发生反应为2Cu2++4I-=I2+2CuI↓)。
③用电感耦合等离子体发射光谱仪测定反应后溶液中c(Cu2+)=0.0125 mol·L-1。
根据上述实验数据,计算卤水样品中I的含量(单位mg·L-1 , 溶液混合前后总体积变化不计,写出计算过程):。

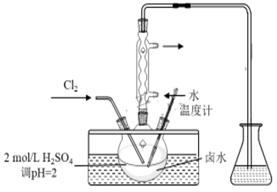
装置A中的试剂是。
①用棕色滴定管盛装AgNO3溶液,其原因是。
②该SO2Cl2产品的纯度为。
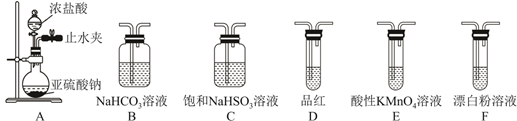
受热易分解,用如图装置加热
固体,试管内有红棕色气体生成,一段时间后,在末端导管口可收集到无色气体a。

气体a的名称是。

已知:①ClO2的浓度较大时易分解爆炸,一般用CO2或空气稀释到10%以下,实验室也常
用稳定剂吸收ClO2 , 生成NaClO2 , 使用时加酸只释放出ClO2一种气体;②ClO2与KI反应的离子方程式为:2ClO2+10I-+8H+=2Cl-+5I2+4H2O;③有关物质沸点如下表:
|
物质 |
CH3OH |
HCOOH |
ClO2 |
|
沸点 |
64.7 ℃ |
100.8 ℃ . |
11 ℃ |
请回答:
①上述物质中,涉及元素形成简单离子半径由大到小的顺序是。
②Na2S又称臭碱,用离子方程式说明Na2S溶液呈碱性的原因。
③Na2SO3溶液中各离子浓度由大到小的顺序是。
④棉织物用氯气漂白后,加入Na2S2O3除去余氯时生成SO ,写出该反应的离子方程式。若反应中生成2molSO
,则转移电子 mol。
②尿素水溶液高于160℃时水解生成NH3和CO2 , 可作为处理NO反应的氨源。通过调整尿素喷入量与汽车尾气流速,得到相同时间内不同投料比[n(尿素)/n(NO)]时NO的转化率随温度变化的a、b的两条曲线如图1所示。
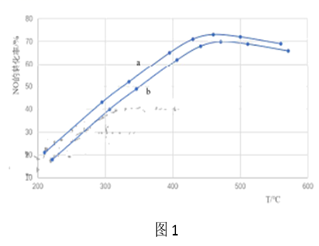
i.曲线a和曲线b,投料比较大的曲线是。(选填“a”或“b”)
ii.当200℃<T<450℃时,NO的转化率随温度升高而增大,原因时温度升高,,反应速率加快。
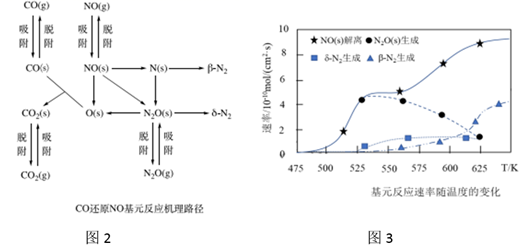
下列说法正确的是_______(填写字母序号)
