 B . 干燥
B . 干燥 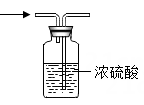 C . 收集
C . 收集  D . 验满
D . 验满 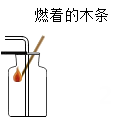

①既可说明甲烷具有可燃性,又说明了甲烷是由氢元素和碳元素组成
②既可说明二氧化碳的密度比空气大,又说明了二氧化碳不能燃烧也不支持燃烧
③既可说明水是由氢元素、氧元素组成,又说明了水分子中氢原子和氧原子的个数之比为2: 1
④既可说明二氧化碳能溶于水,又说明了二氧化碳具有酸性
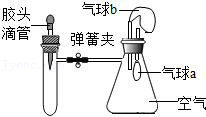
| 试管内物质 | 胶头滴管内物质 | |
| A | 氢氧化钠固体 | 水 |
| B | 铁粉 | 稀盐酸 |
| C | 氯化钡溶液 | 稀硫酸 |
| D | 二氧化碳 | 氢氧化钠溶液 |
 B . 收集O2
B . 收集O2  C . 验证CO2性质
C . 验证CO2性质  D . 观察气体流速
D . 观察气体流速 

 B . 研究二氧化碳可溶于水
B . 研究二氧化碳可溶于水  C . 判断通电螺线管磁性大小
C . 判断通电螺线管磁性大小  D . 证明植物进行呼吸作用
D . 证明植物进行呼吸作用 









①用大号针筒抽取200毫升二氧化碳气体;
②试剂瓶中加入300毫升水(恰好加满),塞紧双孔橡皮塞;
③连接大号针筒和试剂瓶,缓慢推动活塞,将二氧化碳注入水中。

注:整套装置气密性良好,不考虑反应过程中水分和HCl气体挥发的影响,且图甲中产生气流缓慢。
应是:(请用化学方程式表示)。
资料一:早在公元三世纪,张华在《博物志》中就有“烧白石作白灰既讫……”的记载,即如图反应①,其中“白石”即石灰石,“白灰”即氧化钙。
资料二:1754年布莱克首次制得CO2 , 并完成了如图的物质转化研究。
资料三:1769年,英国化学家普里斯特利发现,向水中注入二氧化碳,就可以制作出碳酸水。1823年英国科学家法拉第通过加压得到液态二氧化碳。


碳中和是指通过植树造林、节能减排等形式,抵消产生的二氧化碳排放量,实现二氧化碳“零排放”。现阶段我国的能源结构以化石能源为主,其燃烧释放出大量的二氧化碳。针对我国能源结构的现状,实现碳中和的路径之一是降低化石能源在消费能源中的比例,提高可再生、非化石能源比例。路径之二是捕集、利用和封存二氧化碳。



|
实验序号 |
1 |
2 |
3 |
|
碳酸氢钠片样品质量/克 |
3.0 |
3.0 |
3.0 |
|
反应前总质量/克 |
193.8 |
194.6 |
193.6 |
|
反应后总质量/克 |
192.6 |
193.6 |
192.5 |
|
二氧化碳质量/克 |
请计算药片中碳酸氢钠的质量分数。

请根据图示进行思考并回答下表中的问题:
| (Ⅰ) | (Ⅱ) | (Ⅲ) | (Ⅳ) | |
| 现象 | 紫色纸花变红色 | 紫色纸花不变色 | 紫色纸花不变色 |
|
| 分析 | ①实验(Ⅲ)验证了。 实验(Ⅳ)验证了。 ②通过实验(Ⅰ)、(Ⅳ),可验证酸的一条化学性质是。 ③实验(Ⅳ)结束后,将纸花用酒精灯小心加热烘烤后发现纸花又变成紫色,说明 碳酸,并写出文字表达式。 | |||

腐蚀建筑、损害林木。目前,杭州已开辟“零排放、零污染”的纯电动公交路线超过100条,纯电动汽车是由电动
机驱动的汽车,其电动机的工作原理是。
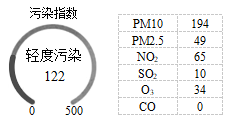
①二氧化碳;②颗粒物;③氮气;④近地低空臭氧;⑤一氧化碳
已知:①该条件下,二氧化碳密度为1.98g/L;

②CaCO3+2HCl=CaCl2+H2O+CO2↑
③一般来说,其他条件相同,增大反应物浓度,化学反应速率加快。

【提出问题】蓝色溶液的溶质是什么?
【提出猜想】猜想一:CuSO4;猜想二:CuSO4 和 H2SO4。
|
步骤 |
实验操作 |
实验现象 |
实验结论 |
|
步骤一 |
在试管 A 中加入少量的 CuO 粉末 |
|
溶液中含有 H2SO4 |
|
步骤二 |
在试管B 中加入过量的NaOH 溶液 |
产生蓝色沉淀 |
溶液中含有 CuSO4 |
写出步骤二中所发生反应的化学方程式:。
方案一:铜和浓硫酸反应方程式:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
方案二:通过以下流程:
从环保角度,同学们认为:工业上不适宜用铜和浓硫酸反应来大量制取硫酸铜,理由是。
“方案一”硫酸和硫酸铜比为 196∶160;
“方案二”硫酸和硫酸铜比为 98∶160。
由此得出:制取相同质量硫酸铜所需的硫酸质量“方案一”是“方案二”两倍,所以采用“方案二”更节约原料。同学们的分析得到了老师的肯定和赞许,老师说实际上用“方案一”制取相同质量硫酸铜所需的硫酸质量远大于“方案二”两倍。请你帮助分析说明理由:。
|
实验一 |
实验二 |
实验三 |
|
段烧石灰石并检验气体产物 |
铁丝在氧气中燃烧 |
研究二氧化碳的性质 |
|
| | |

(提出问题)装置中A溶液的溶质是什么?
(猜想与假设)小滨认为溶质只有CaCl2;
小崔认为除 CaCl2外,可能还含有HCl;
(实验与结论)小滨取反应后装置 A 中部分溶液于试管中,滴加酚酞试液,发现溶液颜色呈无色,于是小滨认为自己的猜想是正确的;
(反思与评价)小崔认为小滨的实验方案是错误的,理由是,为验证后一种物质是否存在,小崔同学可采用(填字母序号):
A.碳酸钠溶液 B.石蕊试液 C.锌粒来代替酚酞试液。

方案一:称量反应前后物质总质量的 (选填“增大”或“减小”)量。
方案二:称量吸收二氧化碳前后盛有氢氧化钠溶液容器质量的 (选填“增大”或“减小”)量。
方案三:选用图中 (填“甲”或“乙”)装置可测量产生的二氧化碳的体积,再根据此时二氧化碳的密度,可计算二氧化碳的质量。