| 实验操作 | 实验现象 | 结论 | |
| A | 将Cl2通入水中制成溶液,向该溶液中加入KMnO4溶液 | KMnO4溶液褪色 | Cl2具有氧化性 |
| B | 将一小块钠投到水中 | 钠浮在水面上 | 钠的密度比水小 |
| C | 在空气中点燃纯净的H2 , 然后把导管缓慢伸入盛满Cl2的集气瓶中 | 纯净的H2在Cl2中安静地燃烧,发出苍白色火焰 | 燃烧不一定需要O2 |
| D | 用红色激光笔照射纳米金的水溶液(纳米金指金的微小颗粒) | 看到一条光亮的通路 | 纳米金的水溶液是一种胶体 |




| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向酸性 | 溶液紫色褪去 | |
| B | 将常温下用冷的浓硝酸处理过的铝片插入硫酸铜溶液中 | 铝片表面无明显现象 | 用硝酸处理后,铝的金属性减弱 |
| C | 向试管中加入5mL10% | 试管内产生砖红色沉淀 | 葡萄糖分子中含有醛基 |
| D | 向新制氯水中加入足量碳酸钙固体,然后用玻璃棒蘸取溶液于pH试纸上 | 氯水颜色变浅,pH试纸颜色褪去 | 加入碳酸钙后,氯水中的HCl被消耗,平衡 |

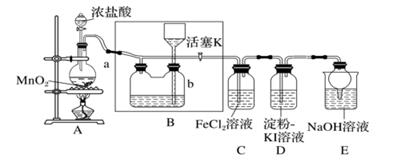

①装置A中的现象是,出现此现象的原因是(用化学方程式和文字解答)。
②装置B的作用是。
③装置C与装置D中的现象是否相同(填“是”或“否” ),根据装置C和D中的现象可以得到的结论是。
④装置E的作用是吸收尾, E中发生反应的化学方程式为。

①在图示的转化中,被还原的元素是,X的化学式为。
②SCR技术可使NOx与NH3直接反应,实现无害转化。当NO与NO2的物质的量之比为2:1时,写出发生反应的化学方程式:。

|
注意事项: 1.本品对棉织品有漂白脱色作用,对金属制品有腐蚀作用。 2.密封保存,请勿与洁厕灵同时使用。 3.保质期为一年 |
“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式:。
①过碳酸钠具有Na2CO3和H2O2的双重性质,50℃开始分解
②2Na2CO3(aq)+3H2O2(aq)=2Na2CO3•3H2O2(aq)△H<0
③过碳酸钠在异丙醇中的溶解度较低
实验室用Na2CO3与稳定剂的混合液和H2O2化合制备过碳酸钠,制备装置如图。

|
t/℃ |
活性氧百分含量/% |
产率/% |
|
5~10 |
13.94 |
85.49 |
|
10~15 |
14.02 |
85.78 |
|
15~20 |
15.05 |
88.38 |
|
20~25 |
14.46 |
83.01 |
a.蒸发溶剂至100℃,冷却结晶
b.蒸发至大量晶体析出,用余热蒸干
c.加入异丙醇
d.用异丙醇溶液洗涤
e.用饱和碳酸钠溶液洗涤
f.抽滤
g.加入氯化钠晶体
h.静置
①取适量过氧碳酸钠样品,用蒸馏水溶解后转移至250mL容量瓶中,定容,摇匀
②用移液管移取25.00mL于锥形瓶中,加入2-3滴甲基橙,用0.2000mol•L-1硫酸标准溶液滴定至终点。重复操作2-3次,记录数据。
③用移液管移取12.50mL于锥形瓶中,加入足量稀硫酸,用0.0200mol•L-1KMnO4标准溶液滴定至终点。重复操作2-3次,记录数据。
经计算发现过氧碳酸钠中碳酸钠与双氧水的比例大于2:3,引起上述结果可能的原因有___。
|
试剂 |
H2O2 |
H2O2+NaCl |
H2O2+Na2CO3 |
H2O2+NaOH |
H2O2+NaOH |
|
pH |
6.01 |
5.97 |
8.14 |
8.15 |
9.26 |
|
溶解氧 |
6.44 |
6.48 |
9.11 |
9.12 |
10.97 |
结合以上数据分析“鱼浮灵”溶于水后在水产养殖中速效增氧的原理是。

在通常状况下,(填“金刚石”或“石墨”)更稳定;石墨的燃烧热ΔH为
用液氯消毒自来水会产生微量有机氯代物,危害人体健康,可使用二氧化氯(ClO2)代替液氯工业上以黄铁矿(FeS2)、氯酸钠(NaClO3)和硫酸溶液混合制备二氧化氯。已知黄铁矿中的硫元素( 价)被氧化成SO42- , 制备二氧化氯的离子方程式为。
①84消毒液有效成分为NaClO。含氯消毒剂中HCO的消毒效果远高于ClO- , 而ClO-的稳定性要高于HClO。
②HClO的K=2.0×10-8;H2CO3的K1=4.3×10-7 , K2=5.6×10-11。
请回答下列问题:

根据图示同学们认为在使用84消毒液时应调节pH在4~6范围内,试说明原因。