

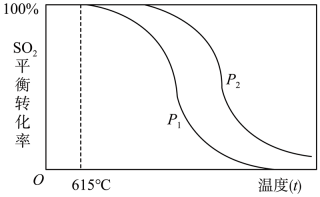
①根据上述信息可以判断:P1P2(填“>”、“<”或“=”)
②随着温度的升高,该反应的化学平衡常数K将(填“变大”、“变小”或“不变”)。
③SO2废气的另一种处理方法是用Na2SO3溶液吸收,得到NaHSO3溶液。

配平步骤①涉及到的方程式(先在括号里补齐生成物):
_Fe2 (SO4)3 + _ H2S =_FeSO4 +_S↓ +_
从图1中选择符合图2要求的X代表的物质:X。



装置乙的作用是。若X为品红溶液,观察到溶液褪色,说明SO2具有(填序号,下同);若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有。
a.氧化性 b.还原性 c.漂白性 d.酸性
Ca2++ClO-+SO2+H2O=CaSO4↓+Cl-++H+
A.CaSO4·2H2O B.Na2SO4·10H2O C.FeS2 D.CuFeS2

①试剂a可选用下列溶液中的(填字母标号)。
A.稀硫酸 B.H2SO3溶液 C.H2O2溶液 D.FeCl2溶液
②该实验的尾气处理不宜采用点燃法,其原因是。
①移开玻璃棒后的实验现象为。
②欲将上述生成的FeS纯化,首先采用磁选法除去剩余的铁粉,然后用(填试剂化学式)将残留的硫粉溶解,随后进行分离、干燥、称重,得到纯净的FeS 2.2 g,则该反应的产率=。
①从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是(填字母标号)。
a. Na2S+S b. Na2SO3+S c. SO2+ Na2SO4 d. Na2SO3+ Na2SO4
②Na2S2O3在空气中易氧化变质,设计实验证明某硫代硫酸钠样品已变质。
 -
-
已知A中反应的化学方程式2FeSO4•7H2OFe2O3+SO2↑+SO3↑+14H2O。
实验开始前打开活塞K1、K2 , 关闭活塞K3 , 通入一段时间N2后,关闭活塞K1、K2 , 打开活区K3 , 高温加热绿矾。
完成下列填空:
为探究SO2与铜盐溶液的反点,在装置C中先后四次加入不同的溶液:
① | ② | ③ | ④ |
已煮沸的BaCl2溶液 | 未煮沸的BaCl2溶液 | 已煮沸的Ba(NO3)2溶液 | 未煮沸的Ba(NO3)2溶液 |
注:锥形瓶中溶液体积相同,钡盐溶液浓度相同;油层厚度一致,通入SO2流速一致。 | |||
得到如图pH-t图:

a.气体通入速率过快 b.未用食用油覆盖液面
c.收集的气体中有CO2 d.沉淀未进行恒重操作
操作步骤 | 实验现象 | 结论 |
①向其中一份 | 有白色沉淀生成 | 证明雾霾固体中含有 |
②向另一份中加,用镊子夹持湿润的红色石蕊试纸靠近试管口 | ③试管中有气泡产生,靠近试管口的红色石蕊试纸变蓝 | 证明雾霾固体中含有 |

测定方法:在某监测点,量取的碘溶液,注入图中的试管中,加几滴淀粉指示剂,此时溶液呈蓝色,按图中装置连接好仪器,利用止水夹控制,进行抽气,取下注射器排气,重复操作直到溶液的蓝色全部褪尽为止,共抽取空气8.0L,则测得该监测点空气中
的含量为mg/L。


①甲同学认为按照A→C→F→尾气处理的顺序连接装置,可以证明与HClO的酸性强弱,乙同学认为该方案不合理,其理由是。
②丙同学采用间接法证明,实验方案为按照A→C→→→→(填字母)→尾气处理顺序连接装置,证明的酸性强于HClO的实验现象是。
甲同学利用在400~500℃脱水制取无水
;利用
在浓硫酸作用下脱水生成CO、
并制备纯净、干燥的CO气体,实验装置如图所示:

B、C中盛放的试剂依次为、。

①上述装置(部分装置可重复使用)的正确连接顺序为C→。
②若E中溶液褪色,则E中发生反应的离子方程式为。
③能证明有生成的实验依据是。

113℃分解得到的固体产物为。
物质 | 熔点/℃ | 沸点/℃ | 其他性质 |
SOCl2 | -105 | 78.8 | 易水解,温度高于150℃分解 |
ClSO3H | -80 | 156 | 具有强吸水性,不易分解 |
S2Cl2 | -77 | 138 | 遇水即反应 |

回答下列问题:
①MnO2和盐酸
②KMnO4和浓盐酸
③漂白粉和浓盐酸
④浓硫酸与NaCl
①BaCl2溶液、稀盐酸
②Ba(NO3)2溶液、稀HNO3
③KSCN溶液
④K3[Fe(CN)6]溶液

查阅资料:
i.2+Cu2+
[Cu(S2O3)2]2-(绿色),2
+Cu+
[Cu(S2O3)2]3-(无色);
ii.相比较 , Cu+更易与NH3络合为[Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+(蓝色);
iii. 易被氧化为
。
提出假设:
假设1:Cu2+与在溶液中发生络合反应生成[Cu(S2O3)2]2-;
假设2:Cu2+与在溶液中发生氧化还原反应。
实验探究一:探究CuSO4与Na2S2O3溶液的反应。
实验操作 | 序号 | V1/mL | V2/mL | 逐滴加入Na2S2O3溶液时的实验现象 |
| a | 1.5 | 0.5 | 溶液逐渐变为绿色,静置无变化 |
b | 1.0 | 1.0 | 溶液先变为绿色,后逐渐变成浅绿色,静置无变化 | |
c | 0 | x | 溶液先变为绿色,后逐渐变浅至无色,静置无变化 |
实验探究二:探究CuCl2与Na2S2O3溶液的反应。


烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)Na2S2O3(aq) (Ⅲ)
回答下列问题:

已知:2NaHSO3Na2S2O5+H2O。
试剂:稀盐酸、稀H2SO4、稀HNO3、BaCl2溶液、酸性KMnO4溶液、H2O2溶液
实验编号 | 实验步骤 | 现象 | 结论 |
I | 取少量样品,加入除氧蒸馏水 | 固体完全溶解得到无色溶液 | / |
II | 取实验I的溶液, | 样品已氧化变质 | |
III | 另取实验I的溶液, | 样品未完全氧化变质 |

已知该反应的化学方程式为:SO2+I2+2H2O=H2SO4+2HI。若空气流速为a m3·min-1 , 当观察到时,结束计时,测定耗时t min。假定样品中的SO2可被溶液充分吸收,该空气样品中SO2的含量是mg·m-3。