
已知:第一电子亲和能是指元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量。
下列说法错误的是

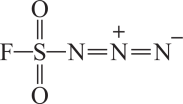

下列有关叙述错误的是

①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5
则下列有关比较中正确的是

 B .
B .  C .
C .  D .
D . 




选项 | M组 | N组 |
A | 酸性强弱:三氟乙酸>三氯乙酸 | F的电负性大于Cl的电负性,导致三氟乙酸羧基中的羟基的极性更大 |
B |
| 因为 |
C |
|
|
D | HI的沸点比HCl的高 | H-I键的键能大于H-Cl键的键能 |
 。
。
a.1s22s22p43s1 b.1s22s22p43d2 c.1s22s12p5 d.1s22s22p33p2

元素 | X | Y | Z | W |
最高价氧化物的水化物 | H3ZO4 | |||
0.1 mol∙L−1溶液对应的pH(25℃) | 1.00 | 13.00 | 1.57 | 0.70 |
①元素的电负性:ZW(填“大于”“小于”或“等于”)。
②简单离子半径:WY(填“大于”“小于”或“等于”)。
③氢化物的稳定性:XZ(填“大于”“小于”或“等于”)。
①写出的最高价氧化物对应水化物与烧碱溶液反应的离子方程式:;
②已知元素和
元素的电负性分别为1.5和4.0,则它们形成的化合物是(填“离子化合物”或“共价化合物”)。
元素 | ||||
电离能 | 1086.5 | 1402.23 | 1313.9 | |
2352.6 | 2856.0 | 3388.3 | ||
a | b | 5300.5 | ||
①元素的原子核外共有种不同空间运动状态的电子。
②由表格中数据可知;原因是。判断ab(填“>或
”)。
a.球形 b.哑铃形


元素 | 元素性质或原子结构 |
W | 电子只有一种自旋取向 |
X | 基态原子的最外层有3个未成对电子 |
Y | 原子核外s能级上的电子总数与p能级上的电子总数相等 |
Z | 在同周期元素中,第一电离能最小 |
N | 最高能级有两对成对电子 |
回答下列问题。
元素 | 相关信息 |
X | 元素原子的核外p电子数比s电子数少1 |
Y | 地壳中含量最多的元素 |
Z | 第一电离能至第四电离能分别是: |
W | 前四周期中电负性最小的元素 |
R | 在周期表的第十一列 |