

 B .
B .  C .
C .  D .
D . 



 XY
B .
XY
B .  X2Y
C .
X2Y
C .  X3Y
D .
X3Y
D .  XY3Z
XY3Z

反应I.
反应II.
反应III.
某压强下在体积固定的密闭容器中,按照投料发生反应I、II、III。平衡时,CO、
在含碳产物中物质的量分数及
转化率随温度的变化如图所示。

n曲线代表的物质为。
②在150~250℃范围内,转化率随温度升高而降低的原因是。

①研究表明,图中过程ii的活化能小但实际反应速率慢,是控速步骤,导致该步反应速率小的原因可能是。
A.对该反应有阻碍作用
B.其它物种的存在削弱了同一吸附位上H的吸附
C.温度变化导致活化能增大
D.温度变化导致平衡常数减小
②已知:图中HCOO为甲酸物种,结构是 ,
,为甲氧基物种。从化学键视角将图中i与ii的过程可描述为。

的原子结构示意图为。
的VSEPR模型为。

①与紧邻的阴离子构成的图形为(填“正四面体”或“正八面体”)。
②晶胞的密度为(阿伏加德罗常数用
表示)。

回答下列问题:

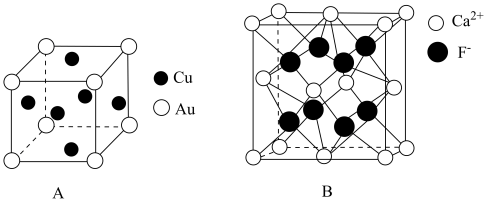
①该晶体中金属原子之间的作用力为。
②该晶体具有储氢功能,氢原子可进入到由Cu原子和Au原子构成的四面体空隙中,若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与(如图B)的结构相似,该晶体储氢后的化学式为。
③已知该合金密度为 , 铜的原子半径为127.8pm,阿伏加德罗常数值为NA , 则Au原子半径r(Au)= =pm(列出计算式)。
①NH4H2PO4的熔点高于苯胺,原因是。
②NH4H2PO4中,电负性最高的元素是;P的杂化轨道与O的2p轨道形成(填“σ”或“π”)键。


①的空间构型是,
中O原子的杂化方式是。
②中的σ键总数为个,图中a处的氢键可表示为
, 请照此画出b处的氢键。
![]()
TiO2+可与H2O2形成配离子[TiO(H2O2)]2+ , 其原因是。


化合物乙中采取sp3方式杂化的原子对应的元素的第一电离能由大到小的顺序为。化合物乙的分子中采取sp3杂化方式成键的原子数目是个。

 )是一种重要的极性溶剂。铭和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题:
)是一种重要的极性溶剂。铭和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题:
 )分别以任意比互溶。
)分别以任意比互溶。①二甲基亚砜分子中硫原子的杂化类型为。
②沸点:二甲基亚砜丙酮(填“>”或“<”)。
③二甲基亚砜能够与水以任意比互溶的原因为。

该晶体的密度为(用含a、b和
的代数式表示,
为阿伏加德罗常数的值)。
①的沸点为136.4℃,而
的沸点为2900℃,其主要原因是。
②中含有(填“极性”或“非极性”,下同)共价键,其属于分子。
③O、Cl、C的电负性由大到小的顺序为(用元素符号表示)。

物质 | 熔点/℃ | 沸点/℃ |
乙酸 | 16.6 | 117.9 |
甲酸甲酯 | -99.8 | 31.5 |
造成二者相差较大的原因是。
①确定固态乙酸是晶体的最可靠的科学方法是。
②已知乙酸的晶胞结构如图所示,其密度是。该晶胞中乙酸的分子数是;若用
表示阿伏加德罗常数的值,则该晶胞的体积为
(列出计算式)。

①中
的配位数为。
②配体中心C原子的杂化方式为:。
③O、N、S三种元素的电负性由大到小的顺序为。

①该晶体中原子个数比为:。
②若晶胞参数分别为a、b
、c
, 阿伏加德罗常数的值为
, 则晶体的密度为
(列出计算表达式)。
|
|
|
|
|
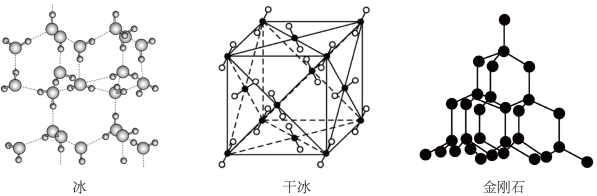
①冰晶体 | ②金刚石晶体 | ③铜晶胞 | ④氯化钙晶胞 | ⑤干冰晶胞 |
上述晶体中,粒子之间以共价键结合形成的晶体是。(用序号填空,下同)
基态N原子的价电子排布图为。
基态Co原子的价电子排布式为,电子占据的最高能层的符号为。

①连接面心上6个构成(填序号)。
A.正四面体 B.正八面体 C.立方体 D.正四边形
②已知NiO晶胞参数为a pm,NA代表阿伏加德罗常数的值。则NiO晶体的密度为(列出计算式)。

配合物离子中Fe的配位数为,
的结构有两种可能的写法,分别为
、
, 则
中
键与
键数之比为,
中C原子的杂化方式为。

①氮原子的最高能级中电子云的形状为。
②晶体中,每个周围与它距离最近且相等的
共有个。
③设阿伏加德罗常数的值为 , 晶胞参数为a pm,则
晶体的密度为
(列出计算式)。
①中N原子的杂化轨道类型为,分子的空间构型为。
②的键角小于
的原因为。
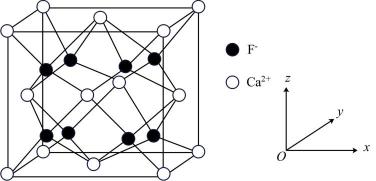
①每个氟化钙晶胞中含有的数目为个;离子晶体中离子的配位数是指一个离子周围最近的异电性离子的数目,则
的配位数为。
②以“![]() ”表示
”表示 , “
![]() ”表示
”表示 , 画出氟化钙晶胞沿z轴方向投影图。
③氟化钙的密度为(列出计算式)。
