

|
|
|
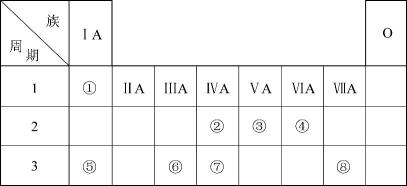
a |
|
|
b |
c |
d |
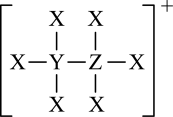


a.原子半径 b.氢化物的稳定性
c.单质的氧化性 d.元素的非金属性
ClO2气体可处理污水中的CN- , 以下是ClO2的两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
反应①: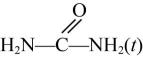 +2CH3OH(g)
+2CH3OH(g)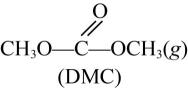 +2NH3(g)
+2NH3(g)
反应②:2NH3(g)+CO2(g) +H2O(l)
+H2O(l)
完成下列填空:
a.酸性: b.最高正价:氮>碳
c.沸点: d.吸引电子能力强弱:氮>碳

A.比较两种元素的单质与冷的浓硫酸反应的速率
B.比较两种元素最高价氧化物对应的水化物的碱性
C.将相同大小的两种元素单质分别放入沸水中,观察反应现象
D.比较相同物质的量的两种元素的单质与足量稀盐酸反应产生的多少
FeBr2(s)+H2O(g)![]() Fe3O4(s)+HBr(g)+H2(g)
Fe3O4(s)+HBr(g)+H2(g)
配平上述化学方程式并标出电子转移的方向和数目。
A.共价键 B.离子键 C.配位键 D.氢键

氧化物 | |||
沸点/℃ | 100 | -10 | -78.5 |
①表中氧化物之间沸点差异的原因为。
②的VSEPR模型为。
③和
分子中,键角更大的是。
①ZnS晶体中,Zn原子在S原子围成的正四面体空隙中的占用率为。
②若阿伏加德罗常数的值为 , ZnS晶体的密度为
, ZnSe晶体的密度为
, 则ZnS晶体中Zn与S原子最短距离和ZnSe晶体中Zn与Se原子最短距离之比为。
 。此有机铜试剂中,C原子的杂化类型有,1mol此有机铜试剂中含有
。此有机铜试剂中,C原子的杂化类型有,1mol此有机铜试剂中含有
