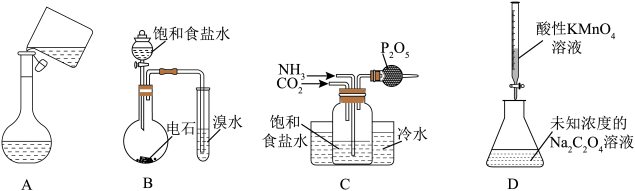



①中物质 | ②中物质 | 预期现象 | |
A | 乙醇 | 酸性KMnO4溶液 | 紫色溶液颜色变浅或退去 |
B | H2S溶液 | Na2SO3溶液 | 溶液变浑浊、产生气泡 |
C | H2O2溶液 | 淀粉KI溶液 | 溶液变蓝 |
D | 浓氨水 | AlCl3溶液 | 生成白色沉淀后又溶解 |

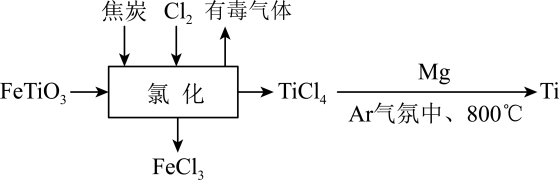
已知:“加热溶解”过程中加入少量浓硝酸起加快反应速率的作用。下列说法错误的( )

已知:溶液pH会影响Pd对的吸附,不影响对H的吸附。
下列说法正确的是( )

“浸锰”过程中,发生反应
, 则可推断:
填“
”或“
”
。
在
溶液中,银锰精矿中的
和氧化锰矿中的
发生反应,则浸锰液中主要的金属阳离子有。
将“浸银”反应的离子方程式补充完整:
结合平衡移动原理,解释浸出剂中
的作用:。
该步反应的离子方程式有。
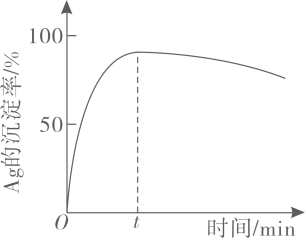
一定温度下,
的沉淀率随反应时间的变化如图所示。解释
分钟后
的沉淀率逐渐减小的原因:。
实验记录如下:
|
|
实验现象 |
|
|
实验Ⅰ |
|
极少量 |
|
实验Ⅱ |
|
部分 |
|
实验Ⅲ |
|
|
初始阶段,
被氧化的反应速率:实验Ⅰ
填“
”“
”或“
”
实验Ⅱ。
实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有
蓝色
或
无色
, 进行以下实验探究:
步骤取实验Ⅲ的深红棕色溶液,加入
, 多次萃取、分液。
步骤取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
步骤
的目的是。
查阅资料,
,
无色
容易被空气氧化。用离子方程式解释步骤
的溶液中发生的变化:。
结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是
, 实验Ⅰ中铜被氧化的化学方程式是。分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入浓
溶液,
填实验现象
, 观察到少量红色的铜。分析铜未完全反应的原因是。


已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
回答下列问题:
A.15.00 mL B.35.00mL C.大于35.00mL D.小于15.00m1
Ⅰ.取mg样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃。用 c mol﹒L-1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+ , 加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2mL。
样品中所含 的质量分数表达式为。
下列关于样品组成分析的说法,正确的是(填标号)。
A. 时,样品中一定不含杂质
B. 越大,样品中
含量一定越高
C.若步骤I中滴入KMnO4溶液不足,则测得样品中Fe元素含量偏低
D.若所用KMnO4溶液实际浓度偏低,则测得样品中Fe元素含量偏高

熔点(℃) | 沸点(℃) | |
甲醇 | -97 | 64.7 |
甲硫醇 | -123 | 7.6 |
完成下列填空:
写出该反应的化学平衡常数表达式。该反应的温度为280~450℃,选该反应温度可能的原因是:①加快反应速率;②。
a.主族元素b.副族元素c.短周期元素d.长周期元素
磷元素的原子核外有种运动状态不同的电子。
NH4H2PO4溶于水形成的溶液中存在:c(H+)+c()=c(OH-)+c(H2PO
)+。
①当CS2的体积分数为10%时,CH4的转化率为。
②当以下数值不变时,能说明该反应达到平衡的是(填序号)。
a.气体密度 b.气体总压 c.CH4与S2体积比 d.CS2的体积分数

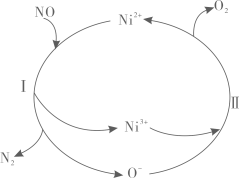
H2S+ NOx= S+ + N2
请完成该制备反应的化学方程式。
_KClO3+_HCl(浓)=_ Cl2↑+_ClO2↑+_KCl+_。
若反应产生8.96LClO2(标准状况)时,则转移电子数为。
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.溶液
在25℃和101kPa时,Na与反应生成
放出510.9kJ的热量,写出该反应的热化学方程式:。
配平上述离子方程式。
该反应说明具有(选填“氧化性”“还原性”或“漂白性”)。

已知:电解效率η的定义为η(B)=×100%
①电极b是极。
②生成的电极反应式是。
③向阳极室和阴极室各加入100mL溶液。制备的同时,还在电极b表面收集到2.5×10-4mol气体,气体是。经测定η(
)为80%,不考虑其他副反应,则制备的(NH4)2S2O8的物质的量浓度为mol/L。
已知:·具有强氧化性,Fe2+浓度较高时会导致
·猝灭。
可将苯酚氧化为CO2 , 但反应速率较慢。加入Fe2+可加快反应,过程为:
ⅰ. +Fe2+=
+
·+Fe3+
ⅱ. ·将苯酚氧化
① ·氧化苯酚的离子方程式是。
②将电解得到的含溶液稀释后加入苯酚处理器,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图。

用等物质的量的铁粉代替FeSO4 , 可明显提高苯酚的降解率,主要原因是。
已知:电解中转移1mol电子所消耗的电量为F库仑
取处理后的水样100mL,酸化后加入KBr溶液,通电。电解产生的Br2全部与苯酚反应,当苯酚完全反应时,消耗的电量为a库仑,则样品中苯酚的含量为g/L。(苯酚的摩尔质量:94g/mol)
不同时,浸出液中
的浓度与含硫化合物总浓度的关系如下图所示(注:含硫化合物总浓度即亚硫酸钠溶液中含硫微粒总浓度)。


+

+
 =
= +
+
 +
+


①甲同学认为固体a中除了MnS外,还有 , 依据的现象是。
②乙同学认为根据上述现象不能得出固体a中含有 , 应补充对比实验:(填实验方案)。实验证实固体a中含有
。
①分析产生的可能原因:酸性条件下,
将
氧化。该反应的离子方程式是。
实验Ⅱ:改用未经酸化的溶液重复实验Ⅰ,产生棕黑色固体时溶液呈绿色。
分析实验Ⅰ未见绿色的原因:取少量实验Ⅱ的绿色溶液,滴加硫酸,溶液变为紫红色,产生棕黑色固体。该反应的离子方程式是。
检验的实验方案:(填操作和现象)。注:该实验条件下,
与
不反应。
|
装置 |
编号 |
试剂 |
实验现象 |
|
|
a |
碘水 |
溶液的棕黄色褪去 |
|
b |
Fe2(SO4)3溶液 |
|
a中反应的离子方程式为。
实验①向第一份溶液中加入K3[Fe(CN)6]溶液,产生蓝色沉淀。
实验②向第二份溶液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
实验③向第三份溶液中先加入稀盐酸酸化,再加入BaCl2溶液,产生白色沉淀。
上述实验不能证明SO2与Fe3+发生了氧化还原反应的是 ,原因是。
|
装置 |
编号 |
试剂 |
实验现象 |
 |
c |
3mol·L-1稀硫酸 |
始终无明显变化 |
|
d |
3 mol·L-1稀盐酸 |
铜片表面变黑,溶液变为棕色 |
已知:i.水合Cu+既易被氧化也易被还原,因此水溶液中无法生成水合Cu+。
ii.CuCl为白色固体,难溶于水,可溶于c(Cl-)较大的溶液生成[CuCl3]2-。
证明d所得棕色溶液含有[CuCl3]2- :用滴管吸取少量棕色溶液,滴入蒸馏水中,出现白色沉淀。用平衡移动原理解释产生该现象的原因是。