





①单独制备:
, 不能自发进行
②单独脱除:
, 能自发进行
协同转化装置如图(在电场作用下,双极膜中间层的解离为
和
, 并向两极迁移)。下列分析错误的是













在保证电极反应不变的情况下,不能替代Cu作电极的是( ) (填字母)。
电解过程中,X极处溶液的OH-浓度(填“增大”“减小”或“不变)。

②原电池装置乙中有明显现象发生时,铁电极上的电极反应方程式为。
③原电池装置丙中,原电池工作时盐桥中的K+移向(填“铜”或“铁”)极,若反应产生2.24L气体(标准状况),则右侧溶液中溶质的质量增加g。
①常温下,溶液中,
(填“>”、“<”或“=”)。
②发生反应生成黄色沉淀的离子方程式是。

①甲溶液是。
②该装置中发生的总反应的离子方程式是。(该反应的平衡常数)。
实验操作:所用试剂:溶液,
溶液,
溶液;向盛有
溶液的试管中滴加2滴
溶液,充分振荡后, (将操作补充完整)。
①该沉淀转化反应的离子方程式是。
②定量分析。由上述沉淀转化反应的化学平衡常数表达式可推导:(列式即可,不必计算结果)。
③同学们结合②中的分析方法,认为教材中的表述:“一般来说,溶解度小的沉淀转化为溶解度更小的沉淀容易实现”,可进一步表述为对于组成形式相同的沉淀,(填“小”或者“大”)的沉淀转化为
(填“更小”或者“更大”)的沉淀容易实现。

当K闭合后,发现电流计指针偏转,b极附近溶液变蓝。
①b极发生的是(填“氧化”或“还原”)反应。
②a极上的电极反应式是。

①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574.0 kJ·mol−1
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) ΔH1=-1160.0 kJ·mol−1
③CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(g) ΔH3
则:ΔH3=kJ·mol−1

①电镀结束后,装置甲溶液中的阴离子除了OH-以外还含有(忽略水解),装置乙中Cu电极的质量将(填“变大”“变小”或“不变” )。
②在此过程中每消耗2.24L(标准状况下)甲烷,理论上装置乙中阴极质量变化g。

①该电解槽的阴极反应式为。此时通过阳离子交换膜的离子数(填“大于”“小于”或“等于”)通过阴离子交换膜的离子数。
②制得的硫酸溶液从出口(填“A”“B”“C”或“D”)导出。

a.碳棒 b.锌板 c.铜板
用电化学原理解释材料B需定期拆换的原因:。

在(填“A”或“C”)区生成。请结合电极反应式分析
产生的过程。

①燃料电池中的负极是(填“M”或“N”)电极,其电极反应为。
②用电极反应式和离子反应方程式解释阳极区域能将酸性含铬废水(主要含有)转化为
的原因。

已知:a.
b.
c.
计算。

甲醇的选择性
①210-270℃间,在甲醇的选择性上,催化效果较好的是。
②210-270℃间,催化剂2条件下的转化率随温度的升高而增大,可能原因为。
下列能说明反应达到化学平衡状态的是(填字母)。
a.相同时间内,键断裂,同时有
键形成
b.容器内气体总压强不再变化
c.
d.容器内气体的密度不再改变
| 时间/min | 0 | 30 | 70 | 80 | 100 |
| | 1.6 | l.0 | 0.8 | 0.8 | 0.8 |
的平衡转化率为;t℃时,该反应的平衡常数K=。

放电时,正极上的电极反应为;若电池工作时产生a库仑的电量,则理论上消耗锌的质量为g。(已知:转移1mol电子所产生的电量为96500库仑)

①若两个电极分别是锌、铜,电解质溶液是稀硫酸,正极的电极反应式;
②当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠时,该原电池的负极为;该原电池的电池总反应为;
③若电池的总反应是 , 正极反应式是;若该电池反应消耗了0.1mol
, 则转移电子的数目约为。

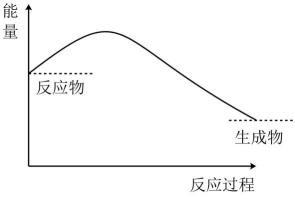
该反应为反应(填“吸热”或“放热”)。
实验编号 | 水果种类 | 电极间距离/cm | 电流 |
|
1 | 番茄 | 1 | 98.7 | |
2 | 番茄 | 2 | 72.5 | |
3 | 苹果 | 2 | 27.2 |
该实验目的是研究水果种类和对水果电池电流大小的影响。

由图中数据分析,该反应的化学方程式为。