选项 | A | B | C | D |
共价晶体 | 石墨 | 生石灰 | 碳化硅 | 金刚石 |
分子晶体 | 冰 | 固态氨 | 氯化铯 | 干冰 |
离子晶体 | 氮化铝 | 食盐 | 明矾 | 芒硝 |
金属晶体 | 铜 | 汞 | 铝 | 铁 |





 B .
B .  C .
C .  D .
D . 




A.  B.
B.  C.
C.  D.
D. 


 )42Cl9]Cl结构中非金属元素的电负性由大到小的顺序是。
)42Cl9]Cl结构中非金属元素的电负性由大到小的顺序是。
|
化合物 |
NaF |
AlF3 |
SiF4 |
SF6 |
|
熔点/℃ |
993 |
1040 |
-90 |
-50.5 |
由表中数值可以判断AlF3晶体类型为,SiF4比SF6熔点低的原因;SF6分子的空间构型为正八面体,如图所示,它的二氯代物SF4Cl2有种。

黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。回答下列问题:
①X分子的立体构型为,中心原子杂化类型为。
②X的沸点比水低的主要原因是。
示为 Π66),则 SO2中的大 π 键应表示为。
①Cu+的配位数为,S2- 的配位数为。
②已 知:a=b=0.524nm,c=1.032nm,NA 为阿伏加德罗常数的值,CuFeS2晶体的密度是g• cm3(列出计算式)。




①钛的配位数为。
②该配合物中存在的化学键有(填字母)。
A.离子键 B.配位键 C.金属键 D.共价键 E.氢键
TiCl4 | TiBr4 | TiI4 | |
熔点/℃ | -24.1 | 38.3 | 155 |
沸点/℃ | 136.5 | 233.5 | 377 |
分析TiCl4、TiBr4、TiI4的熔点和沸点呈现一定变化规律的原因。


KCl与18-冠-6形成的化合物的晶体类型为,这种化合物的熔点比氯化钾(填“高”或“低”),理由是。
 ,在加入18-冠-6以后,相同时间内的产率从24%提高到95%,而18-冠-6没有参与反应过程,18-冠-6的作用是。
,在加入18-冠-6以后,相同时间内的产率从24%提高到95%,而18-冠-6没有参与反应过程,18-冠-6的作用是。

回答下列问题:
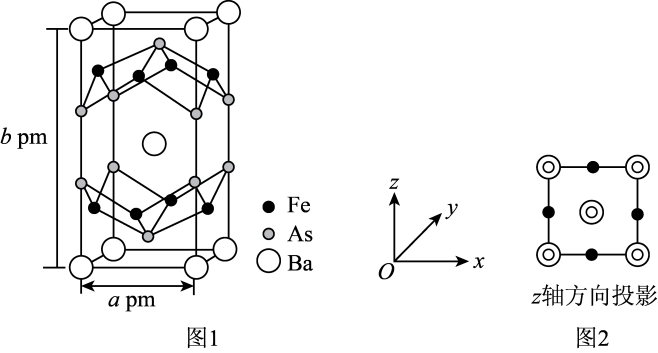
该晶体的化学式为,设NA表示阿伏加德罗常数的值,该晶体的密度是(用含a、b、NA的代数式表示)。
完成下列填空:
①标出上述反应电子转移方向和数目。
②标准状况下,每消耗224mLO2 , 转移电子的数目为个。


①它形成的晶体类型为。
②配体 中
键和
键的个数比为。

①分子中第二周期元素的第一电离能由大到小的顺序为。
②丁二酮肟镍分子中存在的化学键有。
A.共价键 B.氢键 C.离子键 D.金属键 E.配位键
①金刚石 ②氩 ③水晶 ④水银 ⑤氟化钙 ⑥P4 ⑦苯

a.F-的离子半径小于Cl- , 则CaF2的熔点高于CaCl2
b.Ca2+与F-间仅存在静电吸引作用
c.阴阳离子比为2:1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电