


步骤1:向试管中加入1 mL 2% AgNO3溶液,边振荡边滴加2%氨水,观察到有白色沉淀产生并迅速转化为灰褐色。
步骤2:向试管中继续滴加2%氨水,观察到沉淀完全溶解。
步骤3:再向试管中加入1 mL 10%葡萄糖溶液,振荡,在60~70℃水浴中加热,观察到试管内壁形成了光亮银镜。
下列说法错误的是





 B .
B .  C .
C .  D .
D . 

卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
a. b.
c.
d.
②一氯乙烷、一氯乙烯
、一氯乙炔
分子中,
键长的顺序是,理由:(ⅰ)C的杂化轨道中s成分越多,形成的
键越强;(ⅱ)。

已知阿伏加德罗常数为 , 则
晶体的摩尔体积
(列出算式)。


① 为浅紫色,但溶液Ⅰ却呈黄色,其原因是,为了能观察到溶液Ⅰ中
的浅紫色,可采取的方法是。
②已知Fe3+与SCN-、F-的反应在溶液中存在以下平衡: ;
,向溶液Ⅱ中加入NaF后,溶液颜色由红色转变为无色。若该反应是可逆反应,其离子方程式为,平衡常数为(用K1和K2表示)。

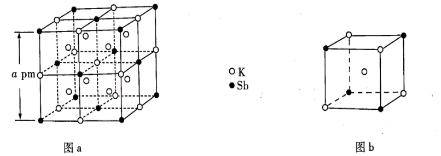
以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在晶胞坐标系中,a点硫原子坐标为 ,b点锰原子坐标为
,则c点锰原子坐标为。

①MnSe晶体可以看成是由Se原子堆成的正八面体中空隙被Mn原子填充,填充率为。
②图2所示单元不是MnSe的晶胞单元,原因为。

③若阿伏加德罗常数的值为NA , 晶体密度为ρg·cm-3 , 则该晶体中Se原子与Mn原子之间最短距离为pm。


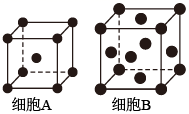
①原子坐标参数表示晶胞内部各原子的相对位置。如图晶胞中,原子坐标参数A(0,0,0);B为( ,
,
);C为(0,1,1)。则D原子的坐标参数为。
②若该晶体的密度是ρg·cm-3 ,则晶胞中两个最近的Fe的核间距为cm(用含ρ的代数式表示,NA表示阿伏加德罗常数的值)。
①该离子中不含的化学键类型有(填字母)。
A.离子键 B.配位键 C.σ键 D.共价键 E.氢键 F.π键
②已知该离子中2个NH3被2个Cl- 替代只得到一种结构,则该离子的立体构型为。


|
坐标原子 |
x |
y |
z |
|
Cd |
0 |
0 |
0 |
|
Sn |
0 |
0 |
0.5 |
|
As |
0.25 |
0.25 |
0. 125 |
①找出此晶胞中距离Cd(0,0,0)最远的As的位置(用分数坐标表示)。
②该化合物的化学式为,此晶体的密度为g·cm-3(列出计算式,阿伏。加德罗常数的值为NA)。




①原子分数坐标可表示晶胞内部各原子的相对位置,图中各原子分数坐标:A为(0,0,0),B为(1,1,0),C为(0,1,1),则D原子的分数坐标为。
②若晶体密度为ρg·cm-3 ,最近的Cu原子核间距为(用含ρ、NA的代数式表示)pm。
①Ga、N、As三种元素的电负性由大到小的顺序是。
②GaN熔点(1700℃)高于GaAs熔点(1238℃)的原因是。
③GaAs可由Ga(CH3)3和AsH3在一定条件下制得,该反应的化学方程式是,Ga(CH3)3分子中Ga原子的杂化方式是,AsH3分子的空间构型是。

①钆镓石榴石的化学式是。
②已知晶体结构单位的边长为a nm,晶体的密度为ρ g·cm−3 , 则阿伏加德罗常数NA=(用含a、ρ的代数式表示)。
①Ca、B、N三种元素电负性从大到小的顺序为。
②BCl3中B原子的轨道与Cl原子的轨道形成σ键;形成BCl3过程中基态B原子价电子层电子先激发,再杂化,激发后B原子的价电子排布图为。
③BCl3在四氯化碳中的溶解度远大于NH3 , 原因是。



①图1中“3”碳原子不处于晶胞面心的理由为。
②同一层中“1”氮原子和“2”氮原子配位数之比为。
③每个“2”氮原子提供个电子参与形成π键。
④已知该晶胞的体积为Vcm3 , 阿伏加德罗常数的值为 ,则该品胞的密度为
。

①立方晶系TiO2晶胞参数如图甲所示,其晶体的密度为g·cm-3(写计算式, NA代表阿伏加德罗常数)。
②图乙TiO2-aNb晶体中a:b=。
 )是一种新型的火箭燃料,因硝基吸电子能力强,中心N原子上无孤电子对,则中心N原子的杂化方式为,并且与三个硝基中的N构成形。
)是一种新型的火箭燃料,因硝基吸电子能力强,中心N原子上无孤电子对,则中心N原子的杂化方式为,并且与三个硝基中的N构成形。

①原子分数坐标可表示晶胞内部各原子的相对位置,图中各原子分数坐标:A为(0,0,0),B为(1,1,0),C为(0,1,1),则D原子的分数坐标为。
②若晶体密度为ρg/cm-3 , 最近的Cu原子核间距为pm(用含ρ、NA的代数式表示)。
①1 mol该配合物中含有molσ键。
②中心离子杂化方式为(填标号)。
a.sp2 b.sp3 c.sp3d d.sp3d2
③Ti3+具有较强还原性的原因是。

①上图TiO2晶胞中钛原子占据个氧原子围成的八面体空隙。
②已知所有的Ti-O键键长为rpm,B点原子的分数坐标为( ,
,
),则A点原子的分数坐标为;晶胞中A、B间距离为pm;TiO2晶体密度为g·cm-3(设NA为阿伏加德罗常数的值)。
③TiO2-x Ny晶体中x=。

回答下列问题:


②EDTA与正二十一烷的相对分子质量非常接近,但EDTA的沸点(540.6℃)比正二十一烷的沸点(100℃)高得多,原因是。
