

已知:a.纯ClO2熔点为-59℃,沸点为11℃ ,纯的ClO2受热或遇光易发生爆炸,一般稀释到10%以下。
b.长期放置或高于60℃时,NaClO2易分解生成NaClO3和NaCl。
a.常温、密封、不避光 b.低温、密封、避光 c.常温、敞口、避光 d.低温、敞口、不避光

反应原理:
相关物质的相对分子质量及部分物理性质:
| 相对原子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| CH3CH2OH | 46 | -114.1 | 78.3 | 与水互溶 |
| CCl3CHO | 147.5 | -57.5 | 97.8 | 可溶于水、乙醇 |
| CCl3COOH | 163.5 | 58 | 198 | 可溶于水、乙醇、三氯乙醛 |
回答下列问题:


②在焙烧炉中,空气从炉底进入,矿石经粉碎后从炉顶进入,这样处理的目的是。
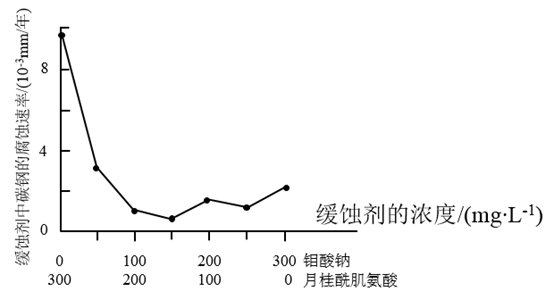
要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为。
a.转入中和液 b.转入结晶Ⅰ操作
c.转入转化液 d.转入结晶Ⅱ操作