
 下列说法正确的是( )
下列说法正确的是( )

已知;Mn元素将以 形式进行分离,其余金属元素若从溶液中分离,都将以氢氧化物的形式析出,部分金属元素开始沉淀与完全沉淀的pH如下表:
| 物质 | | | | |
| 开始沉淀的pH | 2.7 | 7.6 | 7.2 | 9.6 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 11.1 |
下列说法错误的是( )

| 选项 | 实验操作 | 预测现象 |
| A | 向粗乙酸乙酯中加入饱和碳酸钠溶液,振荡 | 有机层的体积减小,有气泡,并分层 |
| B | 向漂白粉中不断加入浓盐酸 | 漂白粉溶解,溶液中逸出无色气体 |
| C | 向AlCl3溶液中不断加入浓氨水 | 先有白色絮状沉淀,然后逐渐溶解 |
| D | 向盛有FeSO4溶液的试管中加入过量Na2O2 | 产生无色气体,先有白色沉淀,再变为灰绿色,最后变为红褐色 |
 下列叙述正确的是( )
下列叙述正确的是( )
(15分)某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含 量过低,对实验的影响可忽略).
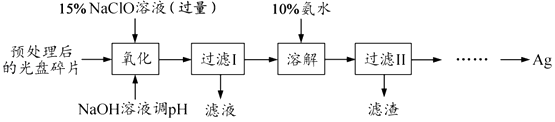
已知:①NaClO溶液在受热或酸性条件下易分解,如 3NaClO═2NaCl+NaClO3
②AgCl可溶于氨水 AgCl+2NH3•H2O⇌Ag(NH3)2++Cl﹣+2H2O
③常温时 N2H4•H2O(水合肼)在碱性条件下能还原 Ag(NH3)2+:
4Ag(NH3)2++N2H4•H2O═4Ag↓+N2↑+4NH4++4NH3↑+H2O
实验室以一种工业废渣(主要成分为MgCO3、Mg2SiO4和少量Fe、Al的氧化物)为原料制备MgCO3•3H2O.实验过程如图1:
MgCO3(S)+2H+(aq)═Mg2+(aq)+CO2(g)+H2O(l)△H=﹣50.4kJ•mol﹣1
Mg2SiO4(s)+4H+(aq)═2Mg2+(aq)+H2SiO3(s)+H2O(l)△H=﹣225.4kJ•mol﹣1
酸溶需加热的目的是;所加H2SO4不宜过量太多的原因是.
①实验装置图中仪器A的名称为.
②为使Fe3+尽可能多地从水相转移至有机相,采取的操作:向装有水溶液的仪器A中加入一定量的有机萃取剂,、静置、分液,并重复多次.
[已知该溶液中pH=8.5时Mg(OH)2开始沉淀;pH=5.0时Al(OH)3沉淀完全].
铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物.
①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+ , 其原因是.
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是.
①一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4﹣(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4﹣ , 其离子方程式为.
②纳米铁粉与水中NO3﹣反应的离子方程式为:4Fe+NO3﹣+10H+═4Fe2++NH4++3H2O。
研究发现,若pH偏低将会导致NO3﹣的去除率下降,其原因是.
③相同条件下,纳米铁粉去除不同水样中NO3﹣的速率有较大差异(见图2),产生该差异的可能原因是.
以硅藻土为载体的五氧化二钒(V2O5)是接触法生产硫酸的催化剂.从废钒催化剂中回收V2O5既避免污染环境
又有利于资源综合利用.废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
“离子交换”和“洗脱”可简单表示为:4ROH+V4O124﹣![]() R4V4O12+4OH﹣(以ROH为强碱性阴离子交换树脂).为了提高洗脱效率,淋洗液应该呈性(填“酸”“碱”“中”).
R4V4O12+4OH﹣(以ROH为强碱性阴离子交换树脂).为了提高洗脱效率,淋洗液应该呈性(填“酸”“碱”“中”).
以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用.其工作流程如下:

i:2Fe2++PbO2+4H++SO42﹣═2Fe3++PbSO4+2H2O
ii:…
①写出ii的离子方程式:.
②下列实验方案可证实上述催化过程.将实验方案补充完整.
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2 , 溶液变红.
b..
PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)⇌NaHPbO2(aq),其溶解度曲线如图所示.

①过程Ⅱ的目的是脱硫.滤液1经处理后可在过程Ⅱ中重复使用,其目的是(选填序号).
A.减小Pb的损失,提高产品的产率
B.重复利用NaOH,提高原料的利用率
C.增加Na2SO4浓度,提高脱硫效率
②过程Ⅲ的目的是提纯,结合上述溶解度曲线,简述过程Ⅲ的操作:
 已知:①
已知:① 可加快酸性浸出的反应速率;
② 、
。
回答下列问题:
A. B.稀硫酸 C.碳酸猛(
)
步骤Ⅰ.向 固体中加入饱和
溶液,水浴加热,缓慢滴入足量5%
溶液,并不断搅拌,观察到有红褐色沉淀产生。
步骤Ⅱ.将Ⅰ中所得体系煮沸,并分批加入饱和 溶液,红褐色沉淀溶解,体系变为亮绿色透明溶液。
步骤Ⅲ.向Ⅱ中所得溶液中加入95%乙醇,经结晶、过滤、干燥制得粗品。
①步骤Ⅰ中除产生红褐色沉淀外,还生成 ,则该反应的化学方程式为。
②步骤Ⅱ中“煮沸”的目的为。
③步骤Ⅲ中加入乙醇的作用为。
步骤i.准确称取 粗品,加硫酸酸化后,用
标准液滴定至终点,消耗标准液体积为
。
步骤ii.向步骤Ⅰ滴定后的溶液中加入适当过量的 粉和适量稀
并振荡,加热至沸腾,过滤除去过量
粉;用稀
洗涤锥形瓶和沉淀,将洗涤液与滤液合并,用
标准液滴定至终点,消耗标准液体积为
。
①步骤i中达到滴定终点的现象为。
②产品中 (已知
)的质量分数为;步骤i中达到滴定终点时仰视读取滴定管读数,会使测定结果(填“偏高”“偏低”或“无影响”)。
③步骤ii中,“洗涤锥形瓶和沉淀”的目的为。
欲制得更纯的三草酸合铁(Ⅲ)酸钾产品,(1)中步骤Ⅲ需增加的操作为。

已知:i. 不溶于水和常见的酸碱,“烧熔”时可转化为酸性氧化物
;
ii. 经“烧熔”后可与沸盐酸反应。

步骤ⅰ:称量mg样品,加水溶解,加入稀硫酸,再滴入 的
溶液使其恰好反应完全。
步骤ⅱ:向步骤ⅰ所得的溶液中加入过量 粉,反应完全后,滤去不溶物,向溶液中滴入酸化的
的
溶液,滴定至终点,消耗
溶液zmL。
①步骤ⅰ中,若加入的 溶液过量,则所测的铁元素的含量(填“偏大”、“偏小”或“不变”,下同),若步骤ⅱ中不滤去不溶物,则所测的铁元素的含量。
②该样品中铁元素的质量分数为(用含m、y、z的代数式表示)。

已知: 时
和
沉淀完全,
时
开始溶解。
回答下列问题:
A. B.
C.
 已知:①
已知:① 为绛蓝色晶体,在溶液中存在以下电离(解离)过程:
、
。
② 和
在水中均可溶,在乙醇中均难溶。若向
溶液中加入乙醇,会析出
晶体。
请回答下列问题:

①仪器a的名称是;仪器d中发生反应的离子方程式是。
②说明检验装置A气密性的方法:。
③装置B的加热方法为水浴加热,其优点是。
该方案存在一定缺陷,因为根据该方案得到的产物晶体中往往含有(填化学式)杂质,其原因是(从平衡移动的角度回答)。
①过滤的主要目的是将固液混合物进行分离。中学化学中常见的固液混合物分离的操作有“倾析法”、“普通过滤法”和“减压过滤法”等,操作示意图如下:

减压过滤法相对于普通过滤法的优点为(填序号,下同)。
A.过滤速度相对较快 B.能过滤胶体类混合物 C.得到的固体物质相对比较干燥
②下列最适合在“洗涤”步骤中作为洗涤液的是。
A.蒸馏水 B.乙醇与水的混合液 C.饱和(NH4)2SO4溶液
 已知:①氧化性:Cu2+>H+(酸)>Ni2+>Fe2+>H+(水);
已知:①氧化性:Cu2+>H+(酸)>Ni2+>Fe2+>H+(水);
②常温下溶度积常数: 、
。
A.防止溶液的酸性过强造成 放电,在阴极生成H2
B.防止溶液的酸性过弱使Ni2+转化成Ni(OH)2沉淀
C.若溶液的pH<2,可加入NiO或Ni(OH)2固体调节溶液的pH
D.使粗镍中所含的杂质Cu在阳极放电而进入电解液中

已知:①活性炭主要吸附有机质;
②25℃时,Ksp[Fe(OH)3]=4.0×10–38;
③氨体系环境中锌元素以[Zn(NH3)4]2+形式存在;
④部分金属离子开始沉淀和完全沉淀的pH:
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | Mn2+ |
| 开始沉淀pH | 1.9 | 7.0 | 4.5 | 8.1 |
| 完全沉淀pH | 3.2 | 9.0 | 6.4 | 10.1 |
请回答以下问题:

NH4Cl浓度对烟灰浸出率的影响
![]() 已知:①I2(s)+I-(aq)
已知:①I2(s)+I-(aq) I
(aq)。
②水合肼(N2H4·H2O)具有强还原性,可将各种价态的碘还原为I- , 氧化产物为N2。
③NaI易被氧化,易溶于水、酒精,在酒精中的溶解度随温度的升高增加不大。
回答下列问题:
②I2与Na2CO3溶液的反应很慢,加入NaI固体能使开始反应时的速率明显加快,原因可能是。
①将步骤Ⅱ得到的pH为6.5~7的溶液调整pH至9~10,在100℃下保温8h,得到溶液A;
②将溶液A的pH调整至3~4,在70~80℃下保温4h,得溶液B;
③将溶液B的pH调整至6.5~7,得溶液C;
④在溶液C中加入活性炭,混合均匀后煮沸,静置10~24h后,过滤除杂得粗NaI溶液。
上述①②③操作中,调整pH时依次加入的试剂为、、。
A.NaOH B.HI C.NH3•H2O D.高纯水
①“减压蒸发”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管、接收瓶之外,还有。
A.直形冷凝管  B.球形冷凝管
B.球形冷凝管 ![]()
C.烧杯  D.抽气泵
D.抽气泵 
②采用“减压蒸发”的优点有:减小压强,降低沸点,利于水的蒸发;。
①高纯水洗涤 ②减压蒸发结晶 ③真空干燥 ④NaI•2H2O粗品溶解 ⑤趁热过滤 ⑥降温结晶

①关闭 ,打开
和分液漏斗活塞,至气球膨胀,目的为;连接B的目的为。
②关闭 ,打开
,向D中通入气体,至黄绿色完全消失。D中反应的化学方程式为。
已知:实验前,D中 的体积为
(已换算为标准状况)。取实验后D中所得溶液,加入适当过量NaI溶液,酸化后充分反应(杂质不参加反应,还原产物为NO);以淀粉为指示剂,用
标准液滴定,达到滴定终点时消耗标准液体积为
。
①NaI发生反应的离子方程式为。
②达到滴定终点的现象为。
③本实验中NOCl的产率为。

将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在仪器b中加入亚硫酸钠固体。在仪器a中注入硫酸,并按如图安装好装置。

仪器a的名称为,装置丙的作用是。
①Na2CO3+SO2=Na2SO3+CO2
②Na2S+SO2+H2O=Na2SO3+H2S
③2H2S+SO2=3S↓+2H2O
④
写出④的反应方程式__。
随着SO2气体的通入,看到溶液中有大量浅黄色固体析出,继续通SO2气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液pH要控制不小于7的理由是:(用文字和相关离子方程式表示)。

为提高产率,操作①为,操作②是过滤洗涤干燥,其中洗涤操作是用(填试剂)作洗涤剂。
 已知:还原烧主反应为
已知:还原烧主反应为 ;
能将
氧化为
请回答下列问题:
步骤E中调节pH至4.5的作用是。

苦卤(含Br)
 →吸收塔
→吸收塔 蒸馏塔
液溴
①向吹出塔中通空气的目的是。
②吸收塔中盛有 溶液,通入足量
蒸气时,有
和无色气体生成,反应的离子方程式是。

①简述 溶液中含
不含
的原因:。
②海水中 ,则
溶液中的溶质是。为了提高产率并防止原料浪费,通电一段时间后,将阴、阳极的斜发沸石对调,继续通电,此时斜发沸石内主要反应的离子方程式是。
A溶液 溶液1(pH为6~7)
溶液2
KI晶体
已知:i. 的溶解度
| 温度/ | 6 | 20 | 60 | 100 |
| | 128 | 140 | 176 | 206 |
ii.
①用化学方程式说明加入 粉的作用:。
②操作1是,过滤,洗涤,干燥。