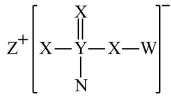
元素 | 相关信息 |
X | 最外层电子数是核外电子总数的一半 |
Y | 在地壳中含量居第三位 |
Z | 单质为淡黄色固体,常存在于火山喷口附近 |
Q | 同周期元素中原子半径最小 |
下列说法正确的是( )
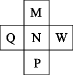
元素 | X | Y | Z | W | T |
原子半径/nm | 0.152 | 0.186 | 0.066 | 0.102 | 0.099 |
最外层电子数 | 1 | 1 | 6 | 6 | 7 |
下列有关说法正确的是( )
族 周期 | I A | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | E | F | ||||||
3 | A | C | D | G | H | |||
4 | B |
这8种元素分别为A,B, C ,D, E ,F, G H 。其中化学性质最不活泼的是。
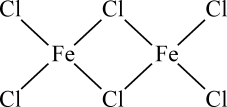 )形式存在,FeCl3的熔点(306℃)是著低于FeF3的熔点(1000℃)的原因是;FeCl3水溶液中Fe3+可水解生成双核阳离子[Fe2(H2O)8(OH)2]4+ , 结构如图所示。在该双核阳离子中,H—O—H键角(填“大于”、“小于”或“等于”)H2O的H—O—H键角;若对FeCl3水溶液进行加热,该对核阳离子内部首先断开的是键(填“a”或“b”)。
)形式存在,FeCl3的熔点(306℃)是著低于FeF3的熔点(1000℃)的原因是;FeCl3水溶液中Fe3+可水解生成双核阳离子[Fe2(H2O)8(OH)2]4+ , 结构如图所示。在该双核阳离子中,H—O—H键角(填“大于”、“小于”或“等于”)H2O的H—O—H键角;若对FeCl3水溶液进行加热,该对核阳离子内部首先断开的是键(填“a”或“b”)。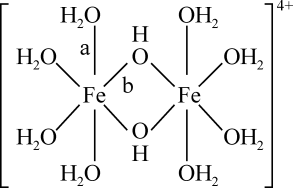
a.离子键|b.氢键 c.配位键 d.金属键
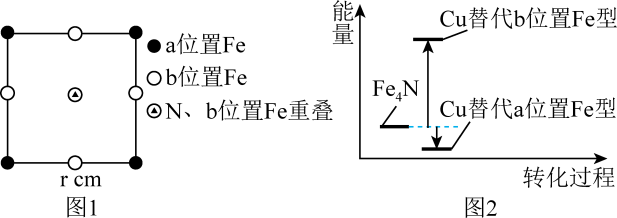

工业上常用于沉淀的廉价试剂①的俗名是。操作Ⅰ的名称是。

步骤B需搅拌、加热煮沸的目的是。步骤C中反应的离子方程式为

|
电离能/kJ·mol-1 |
元素o |
元素p |
|
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
I3 |
3248 |
2957 |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是。

X | R | ||
Y | Z | W |
① ②
②
A.能量最低原理 B.泡利原理 C.洪特规则
甲组同学实验的目的:验证同一主族从上到下金属元素原子失电子能力逐渐(填“增强”或“减弱”,下同);同一周期主族元素从左到右金属元素原子失电子能力逐渐。

仪器A的名称为。
①铜与浓硫酸反应的化学方程式为;装置E中酸性溶液的作用是。
②能说明碳元素的非金属性比硅元素的强的实验现象是。
③该实验能否证明S的非金属性强于C的非金属性?(填“能”或“不能”),理由是。
族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
第一周期 | 1 H 氢 | 2 He 氦 | ||||||
第二周期 | 3 Li 锂 | 4 Be 镀 | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 |
第三周期1 | 1 Na 钠 | 12 Mg 镁 | 33 Al 铝 | 14 Si 硅 | 15 P 磷 | 16 S 硫 | 17 C 氯 | 18 Ar 氩 |
请回答下列问题。
 B .
B . 
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | B | C | D | |||||
3 | E | F | G | H | ||||
元素 | Mn | Fe | |
电离能/kJ·mol | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
表1:Mn、Fe的部分电离能
