
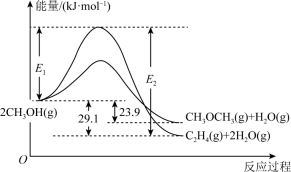
①2CH3OH(g) ⇌ C2H4(g)+2H2O(g) △H1;
2CH3OH(g) ⇌ CH3OCH3(g)+H2O(g) △H2。
下列说法正确的是( )


①若M为钠,则实验过程中烧杯中可观察到的现象是;
②若观察到烧杯里产生气泡,则说明M溶于水(填“一定是放热反应”“一定是吸热反应”或“可能是放热反应”);
③若观察到烧杯里的玻璃管内形成一段水柱,则M可能是。

①装置中仪器A的作用是;
②本实验采用50mL 0.50盐酸、50mL 0.55
氢氧化钠溶液反应,经三次实验测得反应前后的温差平均值为3.3℃,其密度近似地认为均为1
, 反应后溶液的比热容
。则该实验中盐酸和氢氧化钠溶液反应中和热
为;
③下列操作会导致中和热的测定数值偏大的是(填标号);
a.大烧杯上不盖塑料盖板
b.将强酸强碱换成弱酸弱碱
c.用50mL 0.50盐酸与1.1g NaOH固体进行反应
d.将环形玻璃搅拌棒改成环形铜质搅拌棒
e.使用浓硫酸与氢氧化钠溶液进行反应
④若将反应物改为50mL 0.50稀硫酸与50mL 0.55
氢氧化钡溶液,测得反应热为
, 则
(填“>”或“<”),原因是。

A.镁条与盐酸的反应 B.煤的气化
C.煅烧石灰石 D.铝热反应
回答下列问题:

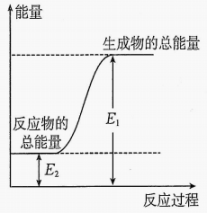
该反应为(填“放热”或“吸热”)反应,生成吸收或放出的热量为。
①液态水汽化 ②生石灰与水反应生成熟石灰 ③
④与固体
混合



|
t/s |
0 |
50 |
150 |
250 |
350 |
|
n(NH3) |
0 |
0.24 |
0.36 |
0.40 |
0.40 |

a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离NH3

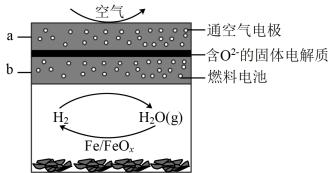
该过程的能量转化形式为,在整个过程中, FeO 的作用是。
②C(s)+O2(g)=CO2(g) ΔH2=bkJ/mol
则过程1的热化学方程式为。
II.以氧化铟(In2O3)作催化剂,采用“CO2催化加氢制甲醇”方法将CO2资源化利用。反应历程如下:
i.催化剂活化: In2O3( 无活性) In2O3-x(有活性) ;
ii.CO2与H2在活化的催化剂表面同时发生如下反应:
反应①: CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH3主反应
反应②: CO2(g)+H2(g)CO(g)+H2O(g) ΔH4副反应
a.升高温度,反应CO(g)+2H2(g)CH3OH(g)的化学平衡常数K (填“增大” “减小”或“不变”)。
b.恒温恒压密闭容器中,加入2molCO2和4molH2 , 只发生反应①和反应②,初始压强为P0。 在230℃以上,升高温度,CO2 的平衡转化率增大,但甲醇的产率降低,可能原因是 。在300℃发生反应,反应达到平衡时,CO2的转化率为50%,容器体积减小20%,则反应②用平衡分压表示的平衡常数Kp= ( 保留两位有效数字)。
