

已知:ⅰ.溶液血红色越深,透光率越小,其它颜色对透光率的影响可忽略
ⅱ.Fe3++4Cl-[FeCl4]-(黄色)

下列说法错误的是( )



I. CO2(g)+ 3H2(g) CH3OH(g)+ H2O(g) ΔH1 = −49 kJ∙mol−1
II. 2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2= −24.5 kJ∙mol−1
III. CO2(g)+H2(g) CO(g)+ H2O(g) ΔH3= +41.2 kJ∙mol−1
回答下列问题:

已知:二甲醚选择性=表示平衡时CH3OCH3选择性的曲线是 (填“X”或“Y” );温度高于300℃时,曲线X的纵坐标随温度升高而增大的原因是。


图2
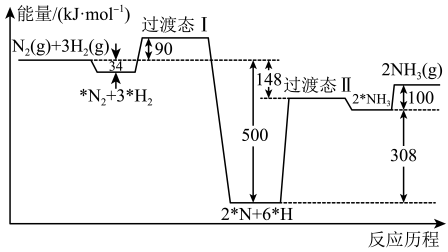
①图2中,该反应的活化能为,该反应的△H=;
②在反应体系中加入Pt2O+作为该反应的催化剂,则△H(填“增大”“减小”或“不变”)。
① △H =-a kJ/mol
② △H =-b kJ/mol
③H2O(g)=H2O(l) △H =-c kJ/mol
则表示CH3OH(l)燃烧热的热化学方程式为。
化学吸附:N2(g)→2N*;H2(g)→2H*
表面反应:N*+H*NH*;NH*+H*
NH2*;NH2*+H*
NH3*
脱附:NH3*NH3(g)
其中,N2吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。请回答:
①前10min的平均反应速率v(H2)=mol•L-1•min-1。
②化学平衡常数K=。


①25℃时,测得0.1mol•L-1CH3COOH溶液的pH=3,则由水电离出的的浓度为mol•L-1。
②CH3COONa溶液显(填“酸性”、“碱性”或“中性”),用离子方程式表示其原因:。
①NH3•H2O的电离方程式为,NH3•H2O的电离平衡常数表达式:Kb=。
②25℃时,0.1mol•L-1氨水的pH=。
③25℃时,向10mL0.1mol•L-1氨水中加入同体积同浓度的盐酸。下列说法正确的是。
a.c(Cl-)>c(NH)>c(OH-)>c(H+)
b.c(Cl-)=c(NH)+c(NH3•H2O)
①若所得混合溶液为中性,则a:b=;
②若所得混合溶液pH=2, 则 a:b=。
①同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是;(用a、b、c表示,下同)
②若三者c(H+)相同时,酸的物质的量浓度由大到小的顺序为;
③将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是。