
已知:ⅰ.与酸反应生成
离子,草酸钕晶体[
]的摩尔质量是
;
ⅱ.生成
, 开始沉淀时
, 完全沉淀时
生成
, 开始沉淀时
, 完全沉淀时
下列说法错误的是( )
 已知:CuS既不溶于稀硫酸,也不与稀硫酸反应。下列说法正确的是( )
已知:CuS既不溶于稀硫酸,也不与稀硫酸反应。下列说法正确的是( )




已知:①氯化胆碱是一种铵盐;
②在溶液中常以
(蓝色)和
(粉红色)形式存在;
③时,
。
回答下列问题:
①晶体(常式尖晶石型)的晶胞示意图如图所示,则顶点上的离子为(用离子符号表示)。
②使用和
溶液可以实现
的修复,则修复过程中的化学反应方程式为。


天青石主要元素质量分数如下:
元素 | |||||
质量分数( | 36.4 | 2.0 | 4.0 | 0.5 | 5.0 |
。
回答下列问题:
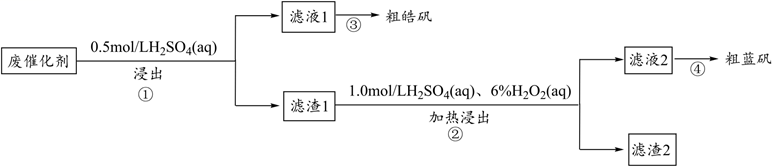
已知钢渣中元素质量分数为
在稀盐酸和
混合溶液中不易被浸出。该工艺条件下,有关金属离子开始沉淀和沉淀完全的
如下表所示:
金属离子 | ||||
开始沉淀的 | 1.9 | 7.2 | 3.5 | 12.4 |
沉淀完全的 | 2.9 | 8.2 | 5.1 | 13.8 |
回答下列问题:




A.1.5~2.0 B.2.0~3.0 C.3.0~4.0 D.4.5~5.0

| 金属离子 | 开始沉淀的 | 沉淀完全的 |
| | 6.8 | 8.3 |
| | 3.7 | 4.7 |
| | 1.8 | 2.8 |
| | 5.2 | 6.7 |
| | 8.6 | 10.1 |
| | 6.7 | 8.2 |


已知:Ksp(FeAsO4)=5.7×10-21 , H3AsO3的还原性比Fe2+强。
回答下列问题:

已知:65℃时Ksp[Mg(OH)2]= 1.8×10-11 Ksp[Zn(OH)2]=2.0×10-17 Kw=10-13 lg2≈0.3
回答下列有关问题:

当用量倍数为2.0时,水相中的金属阳离子主要含
、(填离子符号).

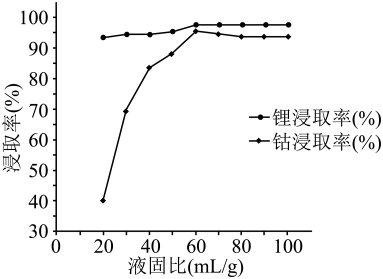
已知:碳酸锂的溶解度(g·L-1)见表。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
回答下列问题




已知:①"萃取"时发生反应有:Sc3++3H2A2(有机液)
Sc(HA2)3(有机相)+3H+Fe3++3H2A2(有机液)
Fe(HA2)3+3H+
②常温下,“萃取”前溶液中c(Sc3+)=0.60mol·L-1 , Ksp[Sc(OH)3]=6.0×10-31;请回答下列问题:


已知:①2[Mg3Si2O5(OH)4]+9(NH4)2SO43(NH4)2Mg2(SO4)3+12NH3↑+4SiO2+10H2O↑;
②2Fe2MgO4+15(NH4)2SO4(NH4)2Mg2(SO4)3+16NH3↑+4(NH4)3Fe(SO4)3+8H2O↑
③常温下,NiSO4易溶于水,NiOOH不溶于水。

沉淀物 | Ni(OH)2 | Fe(OH)3 | 黄铵铁矾 |
开始沉淀时的pH | 7.1 | 2.7 | 1.3 |
沉淀完全(c=1×10-5 mol/L)时的pH | 9.2 | 3.7 | 2.3 |

回答下列问题:

| 开始沉淀的pH | 完全沉淀的pH | |
| | 8.0 | 10.0 |
| | 7.5 | 9.5 |
若将沉铜后的溶液调节至 ,此时溶液中
。
 已知:25℃时,
已知:25℃时, 的
,
;
;
;该工艺中,
时,溶液中
元素以
的形态存在。
①生成 的离子方程式为。
②若条件控制不当, 也会沉淀。为避免
中混入
沉淀,溶液中
(列出算式)时,应停止加入
溶液。
②往滤液Ⅲ中添加适量 固体后,通入足量(填化学式)气体,再通入足量
,可析出
。

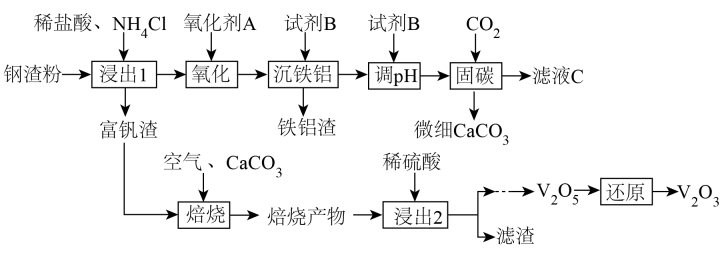
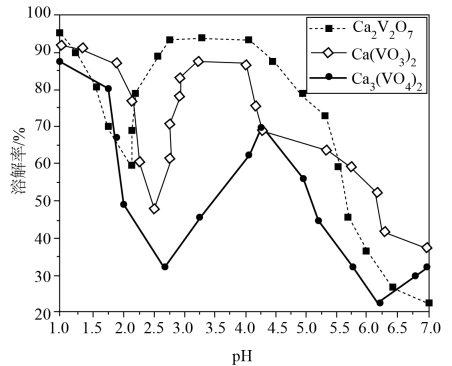
①该氧化物为。
②已知: 和
同族,
和
同族。在
与上层
的反应中,
元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为。
 已知:苯甲酸是一元弱酸,白色片状晶体,常温下微溶于水,温度升高,溶解度增大。
已知:苯甲酸是一元弱酸,白色片状晶体,常温下微溶于水,温度升高,溶解度增大。
回答下列问题: