
氧化还原电对(氧化型/还原型) | 电极反应式 | 标准电极电势 |
0.77 | ||
0.54 | ||
1.36 | ||
1.07 | ||
0.151 |
下列分析错误的是
实验记录如下:
|
|
实验现象 |
|
|
实验Ⅰ |
|
极少量 |
|
实验Ⅱ |
|
部分 |
|
实验Ⅲ |
|
|
初始阶段,
被氧化的反应速率:实验Ⅰ
填“
”“
”或“
”
实验Ⅱ。
实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有
蓝色
或
无色
, 进行以下实验探究:
步骤取实验Ⅲ的深红棕色溶液,加入
, 多次萃取、分液。
步骤取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
步骤
的目的是。
查阅资料,
,
无色
容易被空气氧化。用离子方程式解释步骤
的溶液中发生的变化:。
结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是
, 实验Ⅰ中铜被氧化的化学方程式是。分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入浓
溶液,
填实验现象
, 观察到少量红色的铜。分析铜未完全反应的原因是。

|
装置 |
编号 |
试剂 |
实验现象 |
|
|
a |
碘水 |
溶液的棕黄色褪去 |
|
b |
Fe2(SO4)3溶液 |
|
a中反应的离子方程式为。
实验①向第一份溶液中加入K3[Fe(CN)6]溶液,产生蓝色沉淀。
实验②向第二份溶液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
实验③向第三份溶液中先加入稀盐酸酸化,再加入BaCl2溶液,产生白色沉淀。
上述实验不能证明SO2与Fe3+发生了氧化还原反应的是 ,原因是。
|
装置 |
编号 |
试剂 |
实验现象 |
 |
c |
3mol·L-1稀硫酸 |
始终无明显变化 |
|
d |
3 mol·L-1稀盐酸 |
铜片表面变黑,溶液变为棕色 |
已知:i.水合Cu+既易被氧化也易被还原,因此水溶液中无法生成水合Cu+。
ii.CuCl为白色固体,难溶于水,可溶于c(Cl-)较大的溶液生成[CuCl3]2-。
证明d所得棕色溶液含有[CuCl3]2- :用滴管吸取少量棕色溶液,滴入蒸馏水中,出现白色沉淀。用平衡移动原理解释产生该现象的原因是。
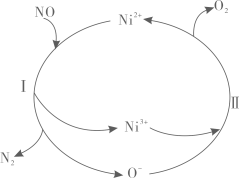
零价铁作为一种还原剂可以提供电子,水中的得电子生成
(氢自由基),
通过双键加成、单电子还原与抗生素发生反应。
氧化反应:。
还原反应:(电中性)。

酸性条件Fe可与溶解氧生成 ,
和
作用生成羟基自由基
和
,
氧化抗生素。
和
生成
的离子方程式是。

已知:酸性介质中,1mol/L不同电对的电极电势见下表。电极电势越高,其氧化型物质的氧化性越强;电极电势越低,其还原型物质的还原性越强。
|
电对(氧化型/还原型) |
|
|
|
|
|
|
电极电势 |
0.771 |
1.776 |
0.695 |
1.224 |
0.536 |
回答下列问题:
催化
分解反应过程包括i、ii两步:
反应i: (未配平)
反应ii:
反应i的离子方程式为。
用可逆反应设计电池,按图a装置进行实验,测得电压E(
)随时间t的变化如图b所示:

电池初始工作时,正极的电极反应式为。
猜想1:增大,
的氧化性减弱,正极的电极电势降低。
猜想2:减小,
的氧化性增强,负极的电极电势升高。
①时间后,按图a装置探究,验证上述猜想的合理性,完成表中填空。
|
实验 |
实验操作 |
电压E/V |
结论 |
|
i |
往烧杯A中加入适量Fe |
E0 |
猜想1成立 |
|
ii |
往烧杯B中加入适量 |
E<0 |
猜想2成立 |
②有同学认为,上述实验不足以证明猜想1成立。利用上述反应,从化学平衡移动的角度解释猜想1不足以成立的理由。
③为进一步验证猜想1,进行实验Ⅱi,完成表中填空。
|
实验 |
实验操作 |
电压E/V |
结论 |
|
iii |
往烧杯A中加入适量 |
E<0 |
猜想1成立 |
结论:可逆氧化还原反应中,浓度的变化引起电对氧化性变化,从而改变电池反应方向。
Ⅰ.B中产生气泡,滴入的溶液紫色褪去。
发生还原反应:
发生氧化反应:。
Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含 , 对其产生的原因提出猜想:
猜想1.有氧化性,能被还原为
猜想2.有性,能与
反应产生
猜想3.……
序号 | 实验 | 试剂 | 现象 |
ⅰ |
| a | 生成棕褐色固体,产生大量气泡 |
ⅱ | b | 有少量气泡 | |
ⅲ |
| 有少量气泡 |
ⅲ是ⅱ和ⅰ的对照实验。
①X是。
②a是、b是。
③取ⅰ中棕褐色固体,滴加浓盐酸,加热,产生黄绿色气体。
①反应的离子方程式是。
②电极反应式:
i还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii氧化反应:。
③根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
i随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱.
ii随c(Cl-)降低,。
④补充实验证实了③中的分析。
|
实验操作 |
试剂 |
产物 |
|
|
I |
| 较浓H2SO4 | 有Cl2 |
| II | a | 有Cl2 | |
| III | a+b | 无Cl2 |
a是,b是。