 B .
B . 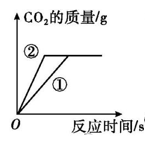 C .
C . 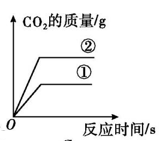 D .
D . 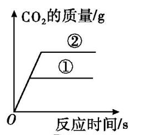
|
|
|
|
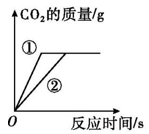
等质量的锌、铁分别与足量的等浓度稀硫酸反应 | 一定量的红磷在充满空气的密闭容器内燃烧 | 向等质量的粉末状碳酸钙和块状碳酸钙中加入等浓度稀盐酸至过量 | 等质量等浓度的双氧水分别在有、无MnO2催化剂条件下分解 |
A | B | C | D |
|
|
|
|
A.向两份完全相同的CaCO3中分别加入足量的5%、10%的稀盐酸,生成CO2质量的变化 | B.高温煅烧一定质量的石灰石,剩余固体质量的变化 | C.20℃时,向接近饱和的KNO3溶液中加入KNO3固体,溶液质量的变化 | D.将5gNH4NO3溶于20mL水中,溶液温度的变化 |
实验目的 | 探究Fe、Cu、Ag的金属活动性强弱 | 利用自制净水器净化水质 | 镁条燃烧验证质量守恒定律 | 验证MnO2能改变反应速率 |
实验设计 |
|
|
|
|
选项 | A | B | C | D |
| 选项 | A | B | C | D |
| 实 验 设 计 | | | | |
| 实验目的 | 探究二氧化锰能否加快过氧化氢分解 | 探究石蜡燃烧后是否有二氧化碳生成 | 检验氧气是否集满 | 测定空气中氧气的含量 |
A | B | C | D | |
实验 设计 |
|
|
|
|
目的 | 比较吸入和呼出气体中CO2含量 | 探究二氧化锰对反应速率的影响 | 证明温度对分子速率的影响 | 证明燃烧的剧烈程度与氧气含量有关 |


下列对比实验的设计不合理的是()
| 选项 | 对比实验 | 探究影响因素 |
| A | ①和② | 反应物的接触面积 |
| B | ②和③ | 温度 |
| C | ②和④ | 温度 |
| D | ③和④ | 反应物的接触面积 |
()
 用带火星的木条比较空气和人体呼出气体中二氧化碳的含量
B .
用带火星的木条比较空气和人体呼出气体中二氧化碳的含量
B .  探究MnO2对过氧化氢分解的影响
C .
探究MnO2对过氧化氢分解的影响
C .  测定空气中氧气含量时,燃烧匙中的红磷越多,水倒吸的就越多
D .
测定空气中氧气含量时,燃烧匙中的红磷越多,水倒吸的就越多
D .  证明蜡烛燃烧生成物中有水
证明蜡烛燃烧生成物中有水
 |  | 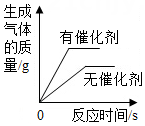 |  |
| A. 在密闭容器中点燃镁条 | B. 高温煅烧一定质量的碳酸钙 | C. 相同的过氧化氢溶液在有、无催化剂的条件下制取氧气 | D. 等质量的块状和粉末状石灰石和稀盐酸反应制取二氧化碳 |
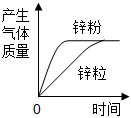 足量的锌粉和锌粒分别与相同浓度、相同质量的稀硫酸反应
B .
足量的锌粉和锌粒分别与相同浓度、相同质量的稀硫酸反应
B .  电解水时,正极产生气体和负极产生气体的体积关系
C .
电解水时,正极产生气体和负极产生气体的体积关系
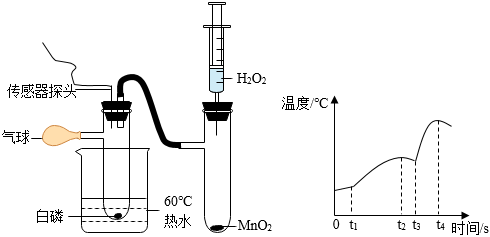
C . 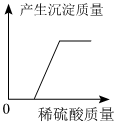 往
往 向一定量的
向一定量的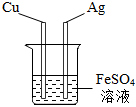 探究铁、银、铜的活动性强弱
B .
探究铁、银、铜的活动性强弱
B .  探究化学反应是否遵循质量守恒定律
C .
探究化学反应是否遵循质量守恒定律
C .  探究影响物质溶解速率的因素
D .
探究影响物质溶解速率的因素
D .  探究影响反应速率的因素
探究影响反应速率的因素

实验标号 | Na2S2O3溶液的体积mL | H2SO4溶液的体积/mL | 蒸馏水的体积/mL |
① | 1.5 | 3.5 | 10 |
② | 2.5 | 3.5 | x |
③ | 3.5 | 3.5 | 8 |
④ | 3.5 | 2.5 | 9 |
⑤ | 3.5 | 1.5 | 10 |

实验编号 | ①验证人体呼出气体中二氧化碳含量比空气中的高 | ②探究影响品红扩散快慢的因素 | ③验证铁钉锈蚀条件 |
实验设计 |
|
|
|
实验分析 | 本实验条件除了要控制两个盛装气体样品的集气瓶大小规格相同外,还要控制相同。 | 发现两杯水都变红,且热水变红时间比冷水要短。由此说明:温度越高,分子运动 | 一周后,左边试管中铁钉生锈,右边试管中铁钉无明显变化。由此说明铁生锈与有关。 |

序号 | 实验过程 | 实验现象 |
1 | 镁粉和铁粉分别与5%盐酸反应 | 镁粉产生气体快 |
2 | 铁粉和铁粉分别与10%盐酸反应 | 铁粉产生气体快 |
3 | 铁片分别与5%盐酸和10%盐酸反应 | 10%盐酸产生气体快 |
由此得出影响金属与酸反应剧烈程度的因素有:
因素一:;
因素二:;
因素三:.


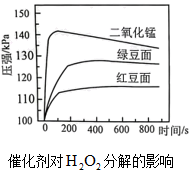
表1 不同质量绿豆面催化过氧化氢相关实验数据的比较
| 催化剂质量/g | 压强最大值/kPa |
10 | 0.6 | 125.2 |
10 | 0.8 | 130.2 |
10 | 1.0 | 134.8 |
10 | 1.2 | 139.0 |
10 | 1.4 | 140.5 |
10 | 1.6 | 136.5 |
10 | 1.8 | 132.7 |
ⅰ.由图可知,不同种类催化剂对分解速率的影响效果是(按由强到弱顺序回答)。
ⅱ.分析表1中实验数据可知,该实验中选用绿豆面且质量为g时的效果最佳。以绿豆而为催化剂,计算制取0.64g氧气所需过氧化氢的质量(写出具体过程,结果保留两位小数)。
ⅲ.若27.2mL某双氧水所含过氧化氢的质量与上述计算结果相同,该双氧水的密度为 , 则其中过氧化氢的质量分数是(保留一位小数)。
农业上用硫酸铜、生石灰加水混合配制常用的杀菌剂波尔多液,但不能用铁制容器配制,原因是(用化学方程式解释)。
【查阅资料】制备硫酸铜的一种方案:Cu+H2O2+H2SO4=CuSO4+2H2O。
【进行实验】将反应物装入烧杯中,观察到如下现象:开始时有少量气泡,后来反应剧烈产生大量气泡,放出热量,溶液呈蓝色,该溶液即为硫酸铜溶液。
【提出疑问】实验中为什么有气体生成?同学们进行了如下探究。
项目四:实验异常现象探究
【查阅资料】制备硫酸铜过程中,H2O2发生了分解反应,生成的气体是
【提出问题】什么因素加快了H2O2分解?
【猜想与假设】
猜想一:生成的CuSO4;
猜想二:温度升高;
猜想三:。

【实验分析】
实验观察到的现象:实验一产生气泡;实验二无明显现象;实验三产生气泡;实验四快速产生气泡,对比实验一和实验二可以得出的结论是。为了验证温度升高能加快H2O2的分解,甲同学的方案是实验二和实验三对比;乙同学的方案是实验一和实验四对比。你认为同学的方案更严谨,理由是。
【实验结论】猜想三正确。
【查阅资料】
活性炭对亚甲基蓝和碘的吸附量可以衡量其吸附效果,吸附量越高,吸附效果越好。
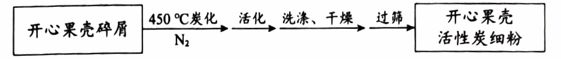
I.制备开心果壳活性炭,流程如下图:
【解释与结论】
①炭化过程,用N2作为保护气,利用N2的主要性质是。
②活化过程,需将炭化得到的炭粉和加入的活化剂充分研磨,其目的是。
【进行实验】室温下,称取2mg开心果壳活性炭置于250mL锥形瓶中,加入100mL一定浓度的亚甲基蓝溶液,密封,吸附一定时间,过滤后测定吸附量。结果如下表:
序号 | 亚甲基蓝初始浓度/mg.L-1 | 吸附时间/min | 吸附量/mg.g-1 |
1 | 100 | 30 | 133.9 |
2 | 150 | 30 | 148.5 |
3 | 200 | 30 | 149.8 |
4 | 200 | 50 | 183.8 |
5 | 200 | 70 | 204.2 |
6 | 250 | 30 | 150.6 |
7 | 300 | 30 | 209.5 |
【解释与结论】
①②③⑥⑦的目的是。
【进行实验】用三种不同方法将使用后的活性炭进行再生处理,通过测定碘吸附量,比较再生效果。结果如下表:
活性炭种类 | 未使用的活性炭 | 使用后的活性炭 | 再生活性炭 | ||
方法1 | 方法2 | 方法3 | |||
碘吸附量/mg.g-1 | 637 | 373 | 611 | 630 | 565 |
【解释与结论】
三种方法中再生效果最好的是(填序号)。
继续实验,发现升高温度,开心果壳活性炭的吸附效果增强。补全实验方案:称取2mg开心果壳活性炭置于250mL锥形瓶中,。
取等纯度、等质量的块状和粉末状贝壳,分别加入足量等浓度的稀盐酸,实验过程中生成气体的体积随时间变化的情况如图所示(贝壳中的杂质不与稀盐酸反应)。

结合实验分析图中曲线,可得出结论:。
小组取10g贝壳,按照如图所示过程进行实验。实验过程中测得不同时刻装置和药品总质量随时间变化的数据见下表。请计算:
时刻 | t0 | t1 | t2 | t3 |
装置和药品总质量/g | 240.00 | 237.00 | 236.48 | 236.48 |

实验中共产生二氧化碳g。