 B . 闻气味
B . 闻气味  C . 测定溶液pH
C . 测定溶液pH  D . 稀释浓硫酸
D . 稀释浓硫酸 
| 选项 | 物质 | 杂质 | 方案 |
| A | Cu粉 | Zn粉 | 加入足量CuCl2溶液后过滤、洗涤、干燥 |
| B | CO气体 | CO2气体 | 通过足量的氢氧化钠溶液后干燥 |
| C | NaCl固体 | Na2CO3固体 | 加入足量的稀盐酸后蒸发 |
| D | BaCO3固体 | BaCl2固体 | 加水溶解再通入足量的二氧化碳后蒸发 |

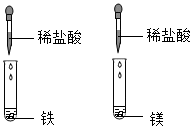 B .
B . 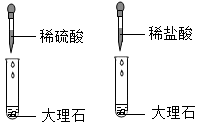 C .
C . 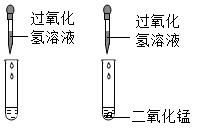 D .
D . 
 B . 苹果汁(pH:3~4)
B . 苹果汁(pH:3~4)  C . 西瓜汁(pH:5~6)
C . 西瓜汁(pH:5~6)  D . 玉米汁(pH:7~8)
D . 玉米汁(pH:7~8) 

| 选项 | 实验目的 | 操作 |
| A | 用氯酸钾和二氧化锰制取氧气后,回收其中的二氧化锰 | 将反应得到的混合物溶解后直接加热蒸发 |
| B | 用向上排空气法收集氧气时,检验氧气是否收集满 | 用带火星的木条伸人到集气瓶中,观察木条是否复燃 |
| C | 鉴别盐酸和硫酸 | 取样后滴加氯化钡溶液,观察是否变浑浊 |
| D | 比较铜和银的化学活动性顺序 | 将两种金属与等质量且同浓度的盐酸反应,观察产生气泡的快慢 |
方案一:分别滴加少量食醋,有气泡产生的是。
方案二:加水溶解,分别滴加溶液,有沉淀产生的是纯碱。
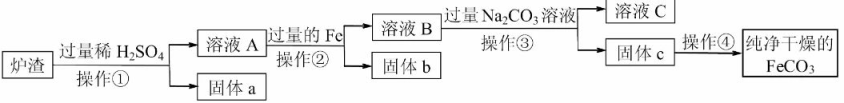
【已知:Fe+Fe2(SO4)3=3FeSO4;SiO2不溶于水,也不与稀硫酸反应】
假设1:氯气溶于水的过程中只有物理变化
假设2:氯气溶于水的过程中既有物理变化又有化学变化
小明向氯水中加入紫色石蕊试液,发现溶液先变红后褪色。由溶液变红可知氯水显 性,从而知道氯气溶于水的过程中发生了化学变化。假设2成立。
A.盐酸有漂白性
B.氯气有漂白性
C.次氯酸有漂白性
经过认真思考,小明否定了假设A,请写出依据 。
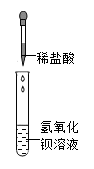
实验室制备的氯气往往带有水蒸气和其他杂质。为了探究氯气是否具有漂白性,必须要用纯净、干燥的氯气。图甲是小明为了干燥氯气所设计的装置图。请在图甲中将广口瓶中的导管画完整,并在图中的处写出试剂名称。最后,将经过除杂后得到的干燥氯气通入装有有色布条的试管中(如图乙),布条颜色不变。得出结论:氯气不具有漂白性。

【提出问题】灰白色沉淀是什么物质?
【提出猜想】小科在老师指导下,猜想灰白色沉淀是下列物质中的一种或几种:
①镁;②氯化镁;③氢氧化镁;④碱式氯化镁[Mg(OH)Cl]。
老师肯定了小科的猜想,并鼓励他继续进行实验探究。
【实验探究】步骤一:将上述镁带与稀盐酸反应后试管内的物质过滤,得到滤液和灰白色滤渣。
步骤二:取滤液于试管中,加入适量的氯化镁粉末,粉末全部溶解。
步骤三:取少量灰白色滤渣于试管中,加入适量稀盐酸,沉淀全部溶解,无其他现象。
步骤四:将剩余滤渣用蒸馏水充分洗涤。取洗涤后的滤渣于试管中,加入过量稀硝酸,滤渣全部溶解,再加入硝酸银溶液,有白色沉淀产生。
【实验反思及结论】
【实验操作】取一块状石灰石于试管中,往试管中加入5毫升稀盐酸。
【实验现象】①开始时固体表面有大量气泡;②反应停止后,试管底部有块状固体残留、固体表面无气泡;③试管内溶液无色。

【继续探究】对原残留液体是否还有盐酸的探究,有同学取原残留液体,滴加AgNO3溶液,产生白色沉淀,再滴加稀硝酸沉淀不溶解。于是根据这一现象,得出了原残留液体中存在盐酸的结论。但小金认为根据这一现象是不能得出原残留液中存在盐酸的结论,小金的理由是。
【实验结论】在原反应结束时,稀盐酸与石灰石没有恰好完全反应,石灰石中碳酸钙有剩余。
步骤二:继续探究
|
实验方案 |
实验操作 |
实验现象 |
实验结论 |
|
Ⅰ |
重新取样,滴加少量AgNO3溶液 |
白色沉淀 |
猜想②正确 |
|
Ⅱ |
重新取样,滴加足量Na2CO3溶液 |
▲ |
猜想②正确 |
|
白色沉淀 |
猜想③正确 |
①对方案Ⅰ的结论进行评价:。
②表格空白处的实验现象是:。
|
实验序号 |
1 |
2 |
3 |
4 |
5 |
|
加入CaCl2溶液质量/克 |
15 |
15 |
15 |
15 |
15 |
|
生成沉淀的总质量/克 |
3 |
m |
9 |
10 |
10 |

求:

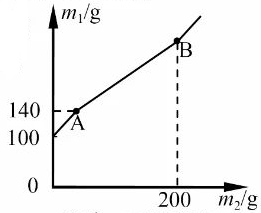
某科学兴趣小组为了测定药片中碳酸氢钠的含量做了以下实验:先将复方碳酸氢钠片制成粉末,取10克分多次放入盛有100克稀盐酸的烧杯中充分反应。测出加入的粉末质量和反应后的溶液质量,两者质量关系如图所示。