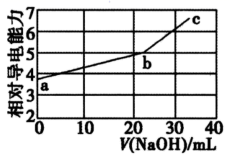
| 现象或操作 | 结论 | |
| A | 相同条件下,分别测量0.1 mol•L-1和0.01 mol•L-1醋酸溶液的导电性,前者的导电性强 | 醋酸浓度越大,电离程度越大 |
| B | 将H2O2溶液滴加到酸性KMnO4溶液中,溶液褪色 | H2O2具有氧化性 |
| C | 常温下将大小相同的铝片分别加入到浓硝酸和稀硝酸中,浓硝酸比稀硝酸反应更剧烈 | 反应物浓度越大,反应速率越快 |
| D | 向碘水中加入CCl4振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
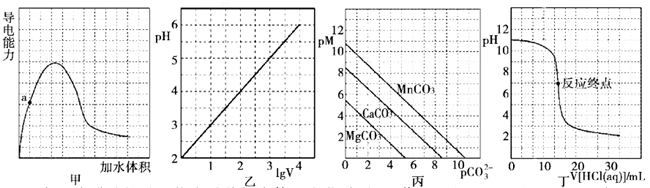
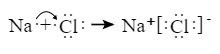 D . 钢铁发生电化学腐蚀的正极反应:
D . 钢铁发生电化学腐蚀的正极反应: 
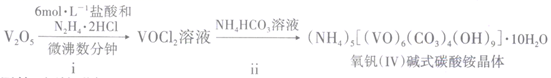
回答下列问题:
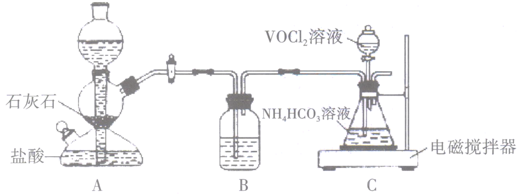
①向锥形瓶中滴加VOCl2溶液前应通入一段时间的CO2 , 目的是。
②装置B中的试剂是。
③反应结束后,将锥形瓶置于干燥器中一段时间,可得到紫红色晶体,然后抽滤洗涤,先用饱和NH4HCO3溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。用饱和NH4HCO3溶液洗涤除去的阴离子主要是,用无水乙醇洗涤的目的是。
称量a g样品于锥形瓶中,用20mL蒸馏水与30mL混酸溶解后,加0.02mol/L KMnO4溶液至稍过量,充分反应后继续加1%NaNO2溶液至稍过量。再用尿素除去过量的NaNO2 , 滴入几滴铁氰化钾{K3[ Fe(CN)6]}溶液,最后用c mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为b mL。滴定反应为: +Fe2++2H+=VO2++Fe3++H2O
①KMnO4溶液的作用是
②滴定终点时的现象为
③粗产品中钒的质量分数的表达式为
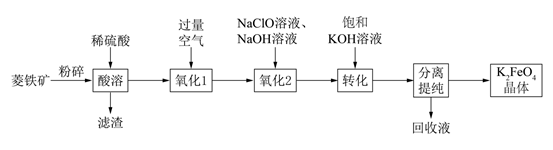
已知:①K2FeO4可溶于水、微溶于浓KOH溶液;
②FeO 在强碱性溶液中稳定,在Fe3+和Fe(OH)3催化作用下发生分解。
回答下列问题:
a.H2SO4溶液 b.KOH浓溶液 c.Fe2(SO4)3溶液
第一次氧化: NaCN与NaClO反应,生成NaOCN和NaCl;
第二次氧化: NaOCN与NaClO反应,生成N2和两种盐(其中一种为酸式盐)。
已知HCN是一种苦杏仁味的无色剧毒液体(常温时,Ka=6.3×10-10),易挥发;HCN、HOCN中N元素的化合价相同。
①第一次氧化时,溶液应调节为 (填 “酸性”“碱性 ”或“中性"), 原因是。
②第二次氧化反应的离子方程式为
③常温下,0.1 mol•L-1 HCN溶液中,c(H+)=(列出计算式)。
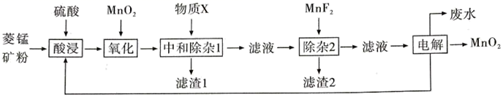
已知:Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10、Ksp(MnF2)=5.0×10-3
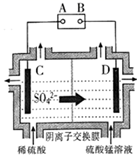
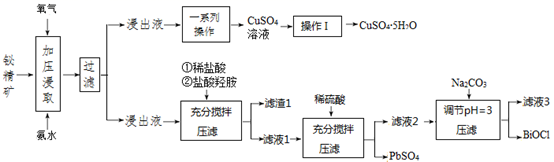 已知: ① Fe(OH)3开始沉淀的 pH值为2.7,沉淀完全时的 pH值为3.7。
已知: ① Fe(OH)3开始沉淀的 pH值为2.7,沉淀完全时的 pH值为3.7。
② 对浸出渣的处理,直至得到产品,都在封闭的管道内进行。
③ pH>3,则 BiCl3极易水解生成不溶性的 BiOCl 沉淀。
请回答以下问题: