


 B .
B .  C .
C .  D .
D . 

2C(s)+O2(g)=2CO(g)ΔH=-220kJ·mol-1
H-H、O=O和O-H的键能分别为436kJ·mol-1、496kJ·mol-1和462kJ·mol-1 , 则a为( )
②2C(s)+O2(g)=2CO(g) ΔH=-221.0 kJ/mol
③2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol
下列判断错误的是( )

H2S(g)+ O2(g)=SO2(g)+H2O(g) ΔH1
H2S(g)+ O2(g)=S(g)+H2O(g) ΔH2
2H2S(g)+SO2(g)= S8(s)+2H2O(l) ΔH3
2H2S(g)+SO2(g)= S8(g)+2H2O(g) ΔH4
8S(g)=S8(g) ΔH5
①C(s)+H2O(g)=CO(g)+H2(g) H1=akJ
mol−1
②CO2(g)+H2(g)=CO(g)+H2O(g) H2=bkJ
mol−1
③CO2(g)+3H2(g)=CH3OH(g)+H2O(g) H3=ckJ
mol−1
④2CH3OH(g)=CH3OCH3(g)+H2O(g) H4=dkJ
mol−1
反应①:C(s)+ O2(g)=CO(g) △H1
反应②:C(s)+H2O(g)=CO(g)+H2(g) △H2
反应③:CO(g)+2H2(g)=CH3OH(g) △H3=-90.1 kJ·mol-1
反应④:2CH3OH(g)=CH3OCH3(g)+H2O(g) △H4 , 能量变化如下图所示

反应⑤:3CH3OH(g) CH3CH=CH2(g)+3H2O(g) △H5=-31.0 kJ·mol-1
下列说法正确的是

2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ•mol﹣1
C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣2 220kJ•mol﹣1
试回答下列问题:
①H2燃烧的反应热为,C3H8燃烧的焓变为。
②1mol H2和2mol C3H8组成的混合气体完全燃烧释放的热量为。
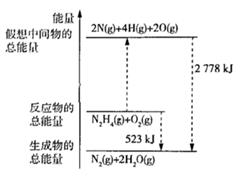
N2(g)+2O2(g)= 2NO2(g) △H= +67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+ 2H2O(g) △H= -534kJ/mol
试写出气态肼(N2H4)与NO2反应生成N2(g)和气态水的热化学反应方程式:
已知:2CO(g)+O2(g) = 2CO2(g) △H1=-566kJ·molˉ1
H2O(g)+CO(g) = H2(g)+CO2(g) △H2=-41kJ·molˉ1
CO(g)+2H2(g) = CH3OH(g) △H3=-107kJ.molˉ1
则CH3OH(g)+O2(g) = CO2(g)+2H2O(g) △H=kJ·molˉ1
①1molN2(g)与适量O2(g)起反应,生成2molNO2(g),吸收68kJ热量。
②4gCO在氧气中燃烧生成CO2 , 放出9.6kJ热量
①反应的热化学方程式为。
②又已知 ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是kJ。
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是。

则M、N相比较稳定的是。

由图可知石墨的燃烧热△H=kJ•mol﹣1。
CH3OH(g)+ O2(g)═CO2(g)+2H2O(1)△H1=akJ•mol﹣1
H2(g)+ O2(g)═H2O(1)△H2=bkJ•mol﹣1
H2O(g)═H2O(l)△H3=ckJ•mol﹣1
则 CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=kJ•mol﹣1。
①石油②煤③天然气④沼气⑤太阳能⑥氢能⑦风能
CH3CH=CH2(g)→CH4(g)+HC CH(g)△H=+32.4kJ/mol
则相同条件下,反应C3H8(g)→CH3CH=CH2(g)+H2(g)的△H=kJ/mol。

①从实验装置上看,图中尚缺少的一种玻璃用品是,烧杯间填满碎塑料泡沫的作用是。
②大烧杯上如不盖硬纸板,则求得的中和热数值(填“偏大”“偏小”“无影响”)。
③实验中改用20mL0.5mol/L的盐酸跟20mL0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”);所求中和热的数值会 (填“相等”或“不相等”)。
①铝片和稀盐酸的反应;②Ba(OH)·8H2O和NH4Cl反应;
③甲烷在氧气中燃烧;④将胆矾加热变为白色粉末;⑤酸碱中和反应;
⑥碘的升华;⑦NaOH固体溶于水;⑧氢气还原氧化铜
| 化学键 | | 氧氧键 | | |
| 能量/( | a | 498 | 946 | 391 |
回答下列问题:
①( 与
反应生成
和
放出的能量为
。
② 与
断键吸收的能量为
。
③ 。
④当有 (l)生成时,放出的能量(填“>”“<”或“=”) 523kJ.
反应A:
已知:①.反应A中
被氧化,放出
的热量。
②. 
断开
键与断开
键所需能量相差
。水分子中H-O键比氯化氢分子中H-Cl键(填“强”或“弱”)。
②H2(g)+ O2(g)=H2O(g) ∆H=-241.8kJ·mol-1 ,
③C(s)+ O2(g)=CO(g) ∆H=-110.5kJ·mol-1 ,
④C(s)+O2(g)=CO2(g)ΔH=-393.5kJ·mol-1 , 回答下列问题:
C燃烧热的热化学方程式为;(填序号)
下列各组试剂混合发生反应的离子方程式为H++OH-=H2O的是___________(填序号)。

据图可判断出反应物的总键能(填“>”“<”或“=”,下同)生成物的总键能,则该反应的反应热∆H 0。
①请写出表示氢气燃烧热的热化学方程式。
②将上述反应设计成下图所示的原电池,其中Y为极(填“正”或“负”),该极电极反应式为。

①该法利用 制取甲醇的有关化学反应如下:
已知:i.断开 中的化学键共吸收
的能量
ii.反应①中部分化学键键能数据如下:
| 化学键 | H-H | H-O |
| 键能/( | 436 | 463 |
由此计算断开 需要吸收kJ的能量,
。
②甲醇燃烧时发生如下反应(a、b、c、d均大于0):
由此知,a、b、c、d由小到大排序为。
③将甲醇完全燃烧生成液态水的反应设计成原电池,以 为电解质。工作时负极的电极反应式。
A.H2(g)+ O2(g)=2H2O(g) ∆H1
B.C(s)+ O2(g)=CO(g) ∆H2
C.CH4(g)+2O2g)=CO2(g)+2H2O(l) ∆H3
D.C(s)+O2(g)=CO2(g) ∆H4
E.C6H12O6(s)+3O2(g)=6CO(g)+6H2O(1) ∆H5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ∆H6
G.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) ∆H7
H.CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ∆H8
已知:CH4(g)=C(s)+2H2(g) △H=+75.0kJ•mol-1
C(s)+O2(g)=CO2(g) △H=-394.5kJ•mol-1
C(s)+ O2(g)=CO(g) △H=-110.5kJ•mol-1
则催化重整反应CH4(g)+CO2(g)=2CO(g)+2H2(g)的△H=kJ•mol-l;从温度和压强的角度考虑,有利于提高CH4平衡转化率的条件是。
反应A:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g) △H=-124.2kJ•mol-1
已知: 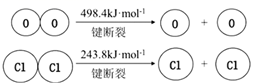
①断开1molH—O键与断开1molH—Cl键所需能量相差为 kJ。
②新型RuO2催化剂对反应A有很好的催化活性。加入催化剂后,该反应的△H(填“变大”、“变小”或“不变”)。