| 选项 | 实验 | 现象 | 结论 |
| A | 相同温度下,用 | 测 | 相同温度下 |
| B | 取 | 溶液不变红 | 反应后固体中可能含有 |
| C | 将湿润的淀粉- | 试纸变蓝 | 该气体为 |
| D | 将少量 | 溶液呈血红色 | |
| 实验操作 | 现象 | 结论 | |
| A | 向某溶液中滴加稀HNO3 , 再加入过量的BaCl2溶液 | 产生白色沉淀 | 原溶液中一定含有SO |
| B | 25℃时分别测定等物质的量浓度的NaHCO3溶液和NaHC2O4溶液的pH值 | NaHCO3溶液的pH更大 | 酸性:H2CO3<H2C2O4 |
| C | 其他条件不变,将H2(g) + I2(g) | 气体颜色变浅 | 减小压强,平衡正向移动 |
| D | 将氯气和甲烷在光照下反应后的混合气体通入紫色石蕊试液 | 紫色石蕊试液变红 | 甲烷的氯代产物具有酸性 |

| 选项 | A | B | C | D |
| 强电解质 | | | | |
| 弱电解质 | | | HClO | |
| 非电解质 | | Al | | |

①福尔马林、聚苯乙烯、油脂、生铁、铝热剂、肥皂均是混合物
②冰和干冰都是酸性氧化物,固体时是分子晶体
③小苏打、硬脂酸钠、BaSO4、 Al2O3都是强电解质
④CO2、NH3、SO2、H2S、Cl2都是非电解质
⑤鸡蛋清溶液、淀粉溶液、烟水晶、雾都是胶体
⑥苯酚、纯碱、胆矾和H2O2分别属于酸、碱、盐和氧化物
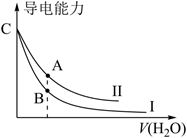

| 弱酸 | CH3COOH | H2CO3 | HClO |
| 电离常数 | K=1.75×10-5 | K1=4.4×10-7 K2=4.7×10-11 | K=3.0×10-8 |
下列叙述错误的是( )
| 酸 | 电离常数(25℃) |
| 碳酸 | Ki1=4.3×10-7Ki2=5.6×10-11 |
| 次溴酸 | Ki=2.4×10-9 |
(用编号回答)其中属于
电解质的是:。
非电解质的是:。
强电解质的是。
弱电解质的是。
①氯化钾②乙醇③醋酸④氨气⑤蔗糖⑥硫化氢⑦硫酸氢钠⑧一水合氨⑨氯气⑩碳酸钡⑪铁
资料:i.HClO的电离常数为Ka=4.7×10-8;
H2CO3的电离常数为K1=4.3×10-7、K2=5.6×10-11。
ii.碘的化合物主要以I-和IO3-的形式存在,IO3-+5I-+6H+=3I2+3H2O。
iii.碘单质能与I-反应:I2+I- I3-(I3-低浓度时显黄色,高浓度时为棕色)。
Ⅰ.制备消毒液(夹持装置略)

将某品牌“84消毒液”稀释10倍,各取100mL于三个烧杯中,设计如下实验方案制备碘水:
|
方案 |
操作 |
现象 |
反应后加淀粉溶液 |
|
1 |
烧杯1溶液中加入9gKI固体 |
溶液为橙黄色 |
…… |
|
2 |
烧杯2溶液中加入9gKI固体再加入1mo/L盐酸10mL |
溶液颜色快速加深,呈紫红色 |
变蓝 |
|
3 |
烧杯3溶液中加入少量KI固体(小于0.5g) |
振荡后溶液保持无色 |
不变蓝 |
对比不同方案的实验现象,得出制取碘水的最佳方法要关注的因素是。
假设1:过量的NaClO将反应生成的I2氧化为IO3-。
设计实验证实了假设1成立。NaClO氧化I2生成IO3-的离子方程式是。
假设2:生成的I2在碱性溶液中不能存在。
设计实验a证实了假设2成立,实验a的操作及现象是。

a.酸性高锰酸钾溶液
b.淀粉碘化钾溶液
c.亚硫酸钠溶液
d.氯化亚铁溶液
甲方案:通过精确测量硬质玻璃管和Cu粉的总质量为c g,进而确定Cu的相对原子质量。
乙方案:通过精确测定U型管b反应前后的质量变化,得到生成水的质量d g,进而确定Cu的相对原子质量。
①请你分析并回答:方案所测结果更准确。若按合理方案测定的数据计算,Cu的相对原子质量为。
②不合理的方案会造成测定结果(填“偏低、偏高或无影响”)。
①设计实验方案如下表,表中c = mol·L-1。
|
编号 |
酸的种类 |
酸的浓度/mol·L-1 |
酸的体积/mL |
镁条质量/g |
|
① |
醋酸 |
1.0 |
10 |
2.0 |
|
② |
盐酸 |
C |
10 |
2.0 |
②实验步骤:(a)检查装置(左图)的气密性后,添加药品;
(b)反应开始后,(填写操作);
(c)将所记录的数据转化为曲线图(右图)。

③写出0~5min醋酸、盐酸分别与镁条反应的反应速率变化规律:。
设计实验方案,将待测物理量和对应的测定方法填写在下表中。
|
待测物理量 |
测定方法 |
|
① |
量取25.00mL醋酸溶液于锥形瓶中,滴加指示剂,将0.1000 mol·L-1 NaOH标准溶液装入中,滴定至终点,记录数据。重复滴定2次。 |
|
② |
|
分析上述反应,下列判断正确的是。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2

a.平衡常数
b.HI的平衡浓度
c.达到平衡的时间
d.平衡时H2的体积分数
a.NaNO3 b.CuSO4
c.Na2SO4 d.NaHSO3
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1=-802 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH2=-566 kJ·mol-1
则反应 3CO2(g)+CH4(g)=4CO(g)+2H2O(g)的ΔH3=kJ·mol-1。

①CO2(g)+CH4(g)=2CO(g)+2H2(g)的ΔH0(填“大于”或“小于”)。
②下列叙述能判断反应CO2(g)+CH4(g)=2CO(g)+2H2(g)达化学平衡状态的是。
A.混合气体的密度保持不变
B.CO的体积分数保持不变
C.c(CO)和c(H2)的比值保持不变
D.断裂4mol C-H键的同时断裂2mol H-H键
③在压强为P1 , 温度为1000℃时,反应经5min达平衡,用CO2表示的化学反应速率v(CO2)=;比较x点和y点的速率:xy(填“大于”“小于”或“等于”);压强p1P2(填“大于”“小于”或“等于”),原因是。
a.适当升高温度 b.加入NH4Cl固体
c.通入NH3 d.加入少量浓盐酸
①加适量醋酸钠晶体后,两溶液中的c(H+)变化情况是:
醋酸溶液中c(H+) (填“增大”、“减小”或“不变”),盐酸溶液中c(H+) (填“增大”、“减小”或“不变”)
②加水稀释10倍后:醋酸溶液中的c(H+)盐酸溶液中的c(H+)(填“>”、“=”或“<”)。
③加等浓度的NaOH溶液至恰好中和,所消耗的NaOH溶液体积相比较:醋酸盐酸(填“>”、“=”或“<”)。
④使温度都升高20 ℃后,两溶液中c(H+)比较:醋酸盐酸(填“>”、“=”或“<”)。
⑤ 分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是(填字母,①代表盐酸,②代表醋酸溶液)。

a.电离程度增大 b.溶液中离子总数增多
c.溶液导电性增强 d.溶液中醋酸分子增多