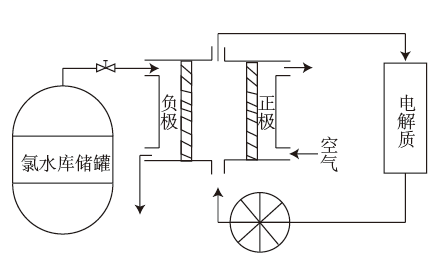


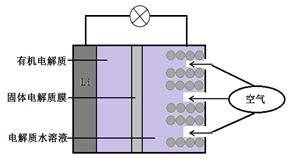

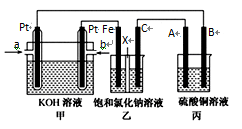
①粗镓与电源极相连(填“正”或“负”)。
②镓在阳极溶解生成的Ga3+与NaOH溶液反应生成GaO2- , GaO2-在阴极放电的电极反应式。
a.NaCl
b.Fe2O3
c.Cu2S
d.Al2O3
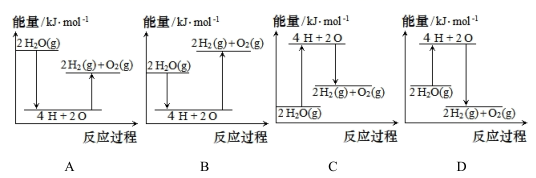
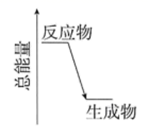
①该反应为(填“放热”或“吸热”)反应,因此在该反应中,断裂化学键吸收的能(填“大于”或“小于”)形成化学键放出的能量。
②下列措施中,能加快氢气生成速率的是(填字母)。
a.将铁片改成铁粉
b.降低稀H2SO4的温度
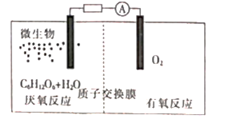
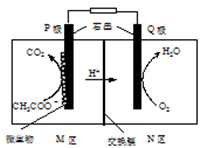
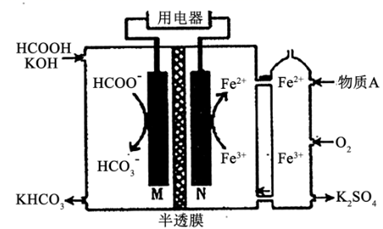
①有氧反应一极是电池的(填“正”或“负”)极,质子交换膜允许 通过,该电池的正极反应式为
②若该电路中转移电子的物质的量为12 mol,则生成CO2的体积(标准状况)为
制备氢气常采用以下方法:
①电解水法:2H2O 2H2↑+O2↑
②水煤气法:C+H2O(g) CO+H2 , CO+H2O
CO2+H2↑
③太阳能光催化分解水法:2H2O 2H2↑+O2↑
三种方法中最节能的是(填标号)。
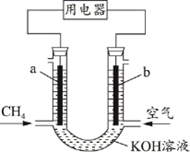
氢燃料电池具有清洁高效等优点,其简易装置如下图所示。

该电池正极反应式为;反应过程中将能转化为能。
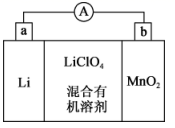
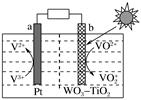
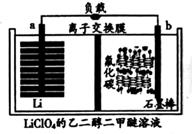
①外电路的电流方向是由极流向极(填字母)。
②电池正极反应式为。
③是否可用水代替电池中的混合有机溶剂?(填“是”或“否”),原因是。
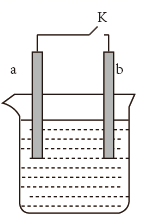
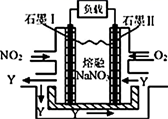
①当开关K断开时产生的现象为。
A.a不断溶解
B.b不断溶解
C.a上产生气泡
D.b上产生气泡
E.溶液逐渐变蓝
②闭合开关K,反应一段时间后断开开关K,经过一段时间后,下列叙述错误的是。
A.溶液中H+浓度减小 B.正极附近 浓度逐渐增大
C.溶液中含有FeSO4 D.溶液中 浓度基本不变
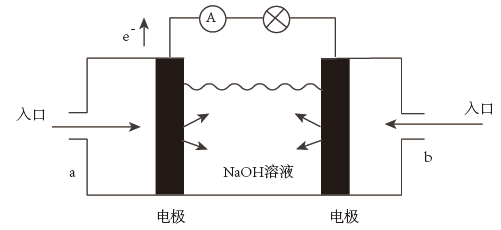
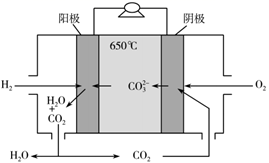
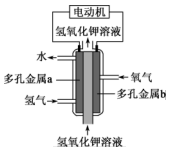
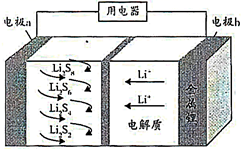
①a极通入的物质为,电解质溶液中的 移向极(选填“负”或“正”)。
②写出此氢氧燃料电池工作时,负极的电极反应式:。
③当消耗氢气11.2L(标准状况下)时,假设电池的能量转化效率为80%,则导线中转移的电子的物质的量为mol。
a.生石灰溶于水 b.浓硫酸稀释 c.碳酸氢钠固体溶于盐酸
d.铜溶于浓硝酸 e.氯化铵固体与氢氧化钡晶体混合搅拌 f.过氧化钠溶于水
查阅资料得知:将作为催化剂的Fe2(SO4)3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的离子方程式分别是:2Fe3++H2O2=2Fe2++O2↑+2H+和。

①当电极a为镁,电极b为铝,电解质溶液为氢氧化钠溶液时,该电池的负极为(填名称)。
②燃料电池的工作原理是将燃料和氧化剂(O2)反应所产生的化学能直接转化为电能。现设计一燃料电池,电极a通入氢气燃料,采用氢氧化钠溶液为电解液,b极的电极反应式为。
③质量相同的铜棒和铁棒用导线连接后插入CuSO4溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12 g,则导线中通过的电子的数目为。