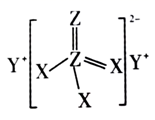
| 编号 | 操作 | 试剂 | 现象 |
| 1 | | ①KCl溶液②稀硝酸酸化的 | 产生白色沉淀 |
| 2 | ①KCl溶液②浓硝酸酸化的 | 产生白色沉淀 | |
| 3 | ①KI溶液 ②稀硝酸酸化的 | 产生黄色沉淀 | |
| 4 | ①KI溶液 ②浓硝酸酸化的 | 产生褐色的浊液 |
下列说法错误的是( )
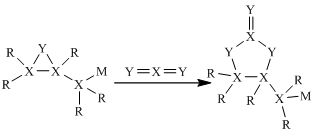
 作催化剂
作催化剂
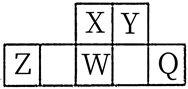
| 选项 | 目的 | 操作 |
| A | 除去Cu粉中混有的CuO | 加入稀硝酸,过滤、洗涤、干燥 |
| B | 探究温度对Fe3+水解程度的影响 | 向25 mL冷水和沸水中分别滴入5滴饱和FeCl3溶液,比较溶液颜色 |
| C | 证明甲苯中的甲基能够活化苯环 | 分别取甲苯和苯与酸性KMnO4溶液反应,观察酸性KMnO4溶液的褪色情况 |
| D | 证明非金属性:Cl>S | 向Na2S溶液中滴加新制氯水,观察实验现象 |
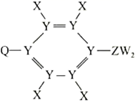
| 选项 | ① | ② | ③ | 实验目的 | |
| A | 浓 | 蔗糖 | 品红溶液 | 检验是否有 | |
| B | 稀 | 某盐溶液 | 澄清石灰水 | 检验盐溶液中是否含有 | |
| C | 浓盐酸 | | | 比较非金属性:Cl与S | |
| D | 浓 | 浓盐酸 | | 比较 |
|
|
IA |
0 |
|||||||
|
1 |
① |
II A |
IIIA |
IV A |
VA |
VIA |
VIIA |
||
|
2 |
② |
③ |
Ne |
||||||
|
3 |
④ |
⑤ |
Al |
S |
⑥ |
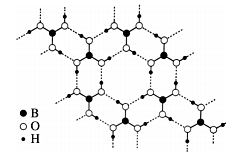
常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如图。1 mol 硼酸(H3BO3)晶体中含有 mol 氢键。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:。
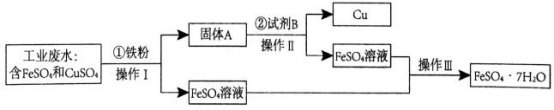
氮化铝的制备
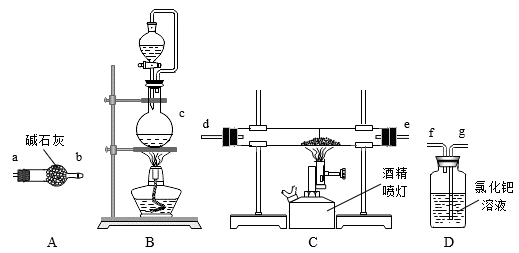
①实验中使用的装置如上图所示,请按照氮气流方向将各仪器接口连接:c→。 (根据实验需要,上述装置可使用多次)
②D装置内氯化钯溶液的作用可能是。
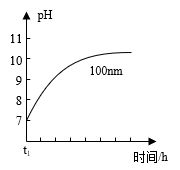
①AlN粉末水解的化学方程式是。
②相同条件下,请在图中画出粒径为40 nm的AlN粉末水解的变化曲线。
①反应的离子方程式是。
②电极反应式:
i还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii氧化反应:。
③根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
i随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱.
ii随c(Cl-)降低,。
④补充实验证实了③中的分析。
|
实验操作 |
试剂 |
产物 |
|
|
I |
| 较浓H2SO4 | 有Cl2 |
| II | a | 有Cl2 | |
| III | a+b | 无Cl2 |
a是,b是。
| 实验方案 | 实验现象 |
| | i.溶液先变黄色,迅速变为棕色 ii.将棕色溶液加热,颜色变浅,冷却 |
资料:FeSO4+NO⇌Fe(NO)SO4(棕色)△H<0
在冷却后的溶液中滴加(填“试剂和现象”),说明有Fe3+生成。从而证明Fe2+可以还原NO 。
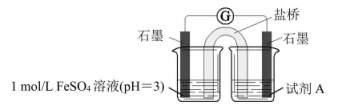
①右侧烧杯中试剂A是。
②实验证据是。