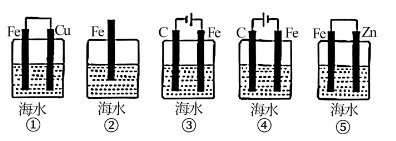
实验组别 混合溶液 | ||||||
30 | ||||||
饱和 | 0 | 0.5 | 2.5 | 5 | 20 | |
10 | 0 |
| 选项 | 实验操作和现象 | 结论或目的 |
| A | 向锌和稀硫酸反应的试管中滴加几滴CuSO4溶液,气泡生成速率加快 | CuSO4是该反应的催化剂 |
| B | 向5 mL0.1 mol/LKI溶液中滴入0.1 mol/LFeCl3溶液5~6滴,加2 mLCCl4振荡,静置后取上层清液滴加KSCN溶液,观察现象 | 验证Fe3+与I的反应有一定限度 |
| C | 将撒有Na2O2的脱脂棉放在石棉网上,然后向其中滴加少量H2O,观察现象 | 验证Na2O2与H2O反应放热 |
| D | | 验证勒夏特列原理 |




 ),电解过程如图所示。下列说法正确的是( )
),电解过程如图所示。下列说法正确的是( ) 
 下列说法正确的是( )
下列说法正确的是( )

①装置中气体A为 (填“CH4”或“O2和CO2”),d极上的电极反应式为 。
②乙装置中a极上的电极反应式为 。若在a极产生112mL(标准状况)气体,则甲装置中消耗CH4 mL(标准状况),乙装置中所得溶液的pH如何变化 (变大、变小、不变)。

编号 | a | b | c | d |
电池装置 |
|
|
|
|
①上述四种电池中,属于二次电池的是(填字母,下同),属于干电池的是。
②a装置中,外电路中电子的流向是(填“从Zn流向Cu”或“从Cu流向Zn”)。
③c装置中,若将电解质改为碱性介质,则负极的电极反应式为。
①该电池的电解质溶液可以是。
②当外电路中转移1mol电子时,电解质溶液的质量增加g。

已知:“滤液”中含有的主要离子为 、
、
等。
回答下列问题:
① 中
元素的化合价为。
②在反应物中加入 粉的最主要目的是(填标号)。
A.提供能量 B.防止 被氧化 C.防止结块
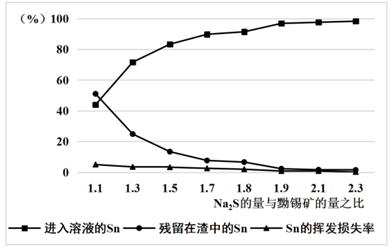
③加入的 的量应为黝锡矿量的2.1倍,结合图示说明其原因。
第一步:
第二步:
①“净化”后溶液应作(填“阳极区”或“阴极区”)电解液。
②“电沉积”过程中,阳极区溶液的 (填“增大”或“减小”或“不变”)。
③“电沉积”结束后,阴极区溶液的主要溶质为(填化学式)。

已知:B是一种气体,C在所有气体中密度最小,D是一种碱;X、Y是生活中应用最为广泛的金属,F是一种红棕色氧化物,常用作红色油漆和涂料;Z为气态氧化物,G为两性氧化物。请回答下列问题:
a.酸性高锰酸钾溶液 b.NaOH溶液 c.KSCN溶液 d.稀硫酸
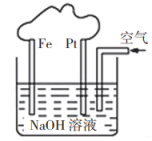
实验室制备氨气的发生装置,可以选择如图装置中的(填序号)。
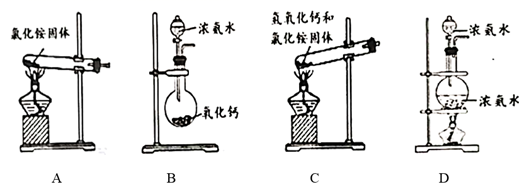

①Z中盛有(填名称);打开 ,关闭
,
能够被
还原,预期观察到Y装置中的现象是。
②氨气与NOx反应的化学方程式为。
电解氧化吸收法可将废气中的 转变为硝态氮。分别向0.1
NaCl溶液和0.08
溶液(起始pH均调至9)中通入NO,测得电流强度与NO的脱除率的关系如图1所示。电解0.1
NaCl溶液时,溶液中相关成分的浓度变化与电流强度的关系如图2所示。

①电解 溶液时产生
。
氧化吸收NO的离子方程式为。
②电解NaCl溶液时,当电流强度大于4A后,NO去除率下降的原因是。
小组同学认为以下两种检验方法,均能证明铁发生了吸氧腐蚀。
|
装置 |
分别进行的操作 |
现象 |
|
| i.连好装置一段时间后,向烧杯中滴加酚酞 | 碳棒附近溶液变红 |
| ii.连好装置一段时间后,向烧杯中滴加K3[Fe(CN)6]溶液 | 铁片表面产生蓝色沉淀 |
①用电极反应式解释实验i中的现象:。
②查阅资料:K3[Fe(CN)6]具有氧化性。有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是。
③为进一步探究K3[Fe(CN)6]的氧化性对实验ii结果的影响,进行下列实验,几分钟后的记录如下:
| 实验 | 胶头滴管 | 试管 | 现象 |
| | 0.5 mol/L K3[Fe(CN)6]溶液 | iii.蒸馏水 | 无明显变化 |
| iv. | 铁片表面产生大量蓝色沉淀 | ||
| v. | 无明显变化 |
a. 以上实验表明:在Cl-存在条件下,K3[Fe(CN)6]溶液可以与铁片发生反应。
b. 为探究Cl-的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验iii,发现铁片表面产生蓝色沉淀。此补充实验表明Cl-的作用是。

①分别取少量容器a、b中的溶液于试管中,滴加K3[Fe(CN)6]溶液,容器a中的溶液所在的试管中出现蓝色沉淀,容器b中的溶液所在的试管中无变化,容器b中铁片做极。
②加热后,电流计指针发生偏转的原因可能是。

| 温度 实验次数 | 起始温度 | 终止温度 | ||
| | | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 30.2 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 |
| 4 | 26.4 | 26.2 | 26.3 | 30.3 |
回答下列问题:
上述实验中温度变化的平均值为 ,若近似认为
稀硫酸与
溶液的密度均为
(忽略溶液混合后体积变化),反应所得溶液的比热容
,则中和热
的数值为
(保留1位小数)。

a是电源的极。