 B .
B .  C .
C .  D .
D . 
①取少量固体于试管中,加适量蒸馏水,固体完全溶解成无色透明溶液。
②取少量上述溶液,加过量稀硫酸,有气泡产生。
③取②中所得溶液少量,滴加BaCl2 溶液,产生白色沉淀。分析上述现象,对原固体组成的推断正确的是( )
⑴取少量该粉末于烧杯中,加入适量蒸馏水,充分搅拌,得无色澄清溶液。
⑵取上述无色溶液少许于试管中,滴加AgNO3溶液有沉淀生成,再加入足量的稀HNO3溶液,沉淀部分溶解。
⑶另称取1.38g该粉末于烧杯中,加入蒸馏水溶解,再加入足量的BaCl2溶液,充分反应后生成1.97g白色沉淀。下列说法正确的是( )
①除去二氧化碳中混有的少量氧气,可以通入一氧化碳后点燃,将氧气转化为二氧化碳;
②实验室用6%的氯化钠溶液配制3%的氯化钠溶液,量取6%的氯化钠溶液时俯视读数,若其他操作均正确,则所配溶液中溶质的质量分数大于3%;
③某固体可能由氯化钠、硫酸钠、氯化钡、氯化镁、硫酸钾中的一种或几种组成,取少量该固体,加入足量的稀氢氧化钠溶液,产生白色沉淀,过滤,向沉淀中加入足量稀硝酸,沉淀部分溶解,则该固体的组成有5种情况;
④某碳酸钠溶液中可能含有另一种溶质,取一定量该溶液,逐滴滴加稀盐酸,产生气体的体积与加入稀盐酸的体积关系如图所示,则该碳酸钠溶液中一定含有氢氧化钠。


下列说法中正确的是( )

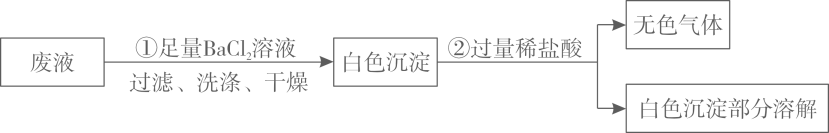
根据以上实验现象分析,可以得出原废液中( )
Ⅰ。现取样品16g于烧杯中并加84g水搅拌,全部溶解。再向烧杯中逐渐滴加26.1%硝酸钡溶液并不断搅拌,烧杯内固体的质量随加入硝酸钡溶液的质量的变化如图甲所示;
Ⅱ。在B点开始,向烧杯中滴加稀硝酸并不断搅拌,烧杯内固体的质量随加入稀硝酸的质量的变化如图乙所示。则下列错误的是( )

步骤一:取少量固体样品于烧杯中,加入足量水溶解,形成无色透明的溶液。再加入足量的BaCl2溶液,有白色沉淀产生;步骤二:过滤得到白色沉淀,往白色沉淀中滴加足量的稀硝酸并不断搅拌,溶液中产生气泡,白色沉淀部分溶解。
①往镁粉和氧化铜的混合物中加入过量稀硫酸,充分反应并过滤,得到滤渣甲和滤液A;
②往滴有无色酚酞的氢氧化钠和硝酸钡的混合溶液中,加入一定量的稀硫酸,充分反应并过滤,得到沉淀乙和无色滤液B;
③将滤液A和B充分混合后,得到沉淀丙和滤液C; ④往滤液C中滴加氯化钡溶液,没有沉淀产生。
回答下列问题:



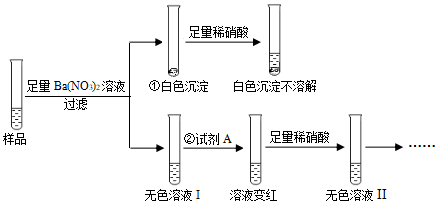
步骤Ⅰ:取少量固体样品置于烧杯中先加足量水溶解,再加入足量的BaCl2溶液,有白色沉淀产生。
步骤Ⅱ:继续向烧杯中滴加稀盐酸并不断搅拌,烧杯内固体质量随加入稀盐酸质量的变化如图所示,请回答下列问题:

|
实验内容 |
观察到的现象 |
|
A+B |
有气泡产生 |
|
A+C |
有白色沉淀生成 |
将三瓶无色溶液任意编号为A、B、C,各取少量进行实验,得到相关的实验记录(如表)。
请你判断B是溶液(填化学式);写出A与C反应的化学方程式。
①用三支试管分别取少量三种无色溶液;②滴加少量的;③观察现象;④得出结论。

请回答下列问题:


以下是一种制备精盐的实验方案,步骤如下:
回答下列问题:
2


②氯化钙稀溶液与碳酸氢铵溶液不发生反应。③氨气能与硫酸化合生成硫酸铵。
(提出问题)嗅盐中盐类物质是什么?
(实验探究)填写表中空格。
|
实验 |
小军的实验 |
小英的实验 |
|
|
方案 |
嗅盐与(填一种物质名称)混合研磨 | | |
| 现象 | 闻到较浓烈刺激性气味且试纸变蓝 |
|
|
| 结论 | 嗅盐中含有NH4+ | 嗅盐中含有CO32- | 确认了小军的实验结论 |
| 证明嗅盐中盐类物质是碳酸铵 | |||
(质疑)小英认为小军的实验不严谨,小英通过补做一个实验(方案见上表),进而确认了小军的结论。
【提出问题】该滴瓶中溶质的成分是什么?
猜想Ⅰ溶质成分只有:KCl; 猜想Ⅱ溶质成分为:KCl和KOH;
猜想Ⅲ溶质成分为:KCl、K2SO4; 猜想Ⅳ溶质成分为:KCl、KOH和K2SO4 .
【实验探究】为证明猜想,小军设计了如下实验方案,请你一起完成下列实验报告;
|
实验操作 |
实验现象 |
结论或解释 |
|
(1)取该滴瓶内溶液于试管中,向试管中加入适量BaCl2溶液 |
|
溶质中有K2SO4 |
|
(2)将上述反应后的混合液过滤,取滤液于另一支试管中,向该试管中加入酚酞试液 |
|
证明猜想Ⅳ成立 |
[猜想与假设]猜想I;白色粉末是碳酸钠。
猜想Ⅱ:白色粉末是氢氧化钠。
猜想Ⅲ:白色粉末是。
[查阅资料]CaCl2溶液、Ca(NO3)2溶液呈中性。
[实验探究]取白色粉末溶于水形成溶液A,设计如下实验:

⑴由上述实验可知,猜想肯定不成立。
⑵适合操作③的X溶液是(填字母序号)。
A.CaCl2溶液 B.Ca(OH)2溶液 C.Ba(OH)2溶液
⑶操作④需要用到的一种玻璃仪器。


分析曲线甲,M点电导率几乎为零,请从离子角度分析原因 。
交流与反思;通过以上实验的比较分析,让我们对溶液中复分解反应实质有了更深层的理解,即 。
|
实验操作 |
实验现象 |
实验结论及分析 |
|
Ⅰ.取少量该固体粉末于烧杯中,加入足量的水溶解、过滤 |
粉末部分溶解,得到白色滤渣和无色滤液 |
滤渣中一定含有 |
|
Ⅱ.向滤液中滴加无色酚酞试液 |
溶液变红 |
滤液中可能含有物质(填“酸性”“碱性”或“中性”) |
|
Ⅲ.向Ⅱ中所得溶液滴加足量稀盐酸 |
|
原固体粉末中一定含有Na2CO3 |
取21.0g该固体粉末,加入160.0g10%的稀盐酸,恰好完全反应,实验测得产生8.8g二氧化碳,将反应后溶液继续蒸发结晶,得到固体,测定所得固体中含16.0g氯元素。试综合甲、乙两组同学的实验进行分析并填空。
①乙组实验中一定发生的化学反应是:①CaCO3+2HCl=CaCl2↑+H2O+CO2↑②。
②固体粉末的组成中除Na2CO3外,一定还含有的物质是,可能含有的物质是(均填写化学式)。

请分析实验过程并完成以下问题:

Ⅰ.取少量固体于烧杯中,逐渐加水并不断搅拌,烧杯内固体的质量随加入水的质量的变化如图1所示。
Ⅱ.取少量B点时的溶液于试管中,滴加酚酞试液,溶液不变色。
Ⅲ.继续向烧杯中滴加稀硝酸并不断搅拌,烧杯内固体的质量随加入稀硝酸的质量的变化如图2所示。
请回答下列问题: