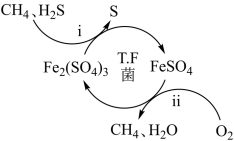

几种化学键的键能:
化学键 | H-O | O=O | H-H | O-O |
键能/( | 463 | 496 | 436 | 138 |
下列说法错误的是( )
投料比
温度/℃ | |||
200 | 1.70 | 0.21 | 0.02 |
250 | 2.73 | 0.30 | 0.06 |
300 | 6.00 | 0.84 | 0.43 |
350 | 7.85 | 1.52 | 0.80 |
下列说法不正确的是( )
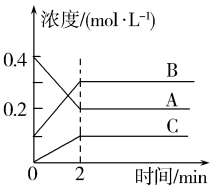
实验 | c(NO)/mol·L-1 | c(H2)/mol·L-1 | v(正)/mol·L-1·min-1 |
① | 0.10 | 0.10 | 0.414k |
② | 0.10 | 0.40 | 1.656k |
③ | 0.20 | 0.10 | 1.656k |
下列有关推断正确的是( )
化学键 | H—H | H—O | I—I | H—I | O=O |
键能kJ·mol-1 | 435 | 460 | 150 | 300 | 500 |
①由氢气与氧气生成18g水放出的热量为kJ。
②若将1molI2和1molH2置于密闭容器中,并在上述条件下反应,发现热量实测值(恢复到25℃,101kPa)远小于15kJ,你认为最可能的原因是。

|
方案 |
假设 |
实验操作 |
|
I |
, 反应速率加快 |
向烧杯中加入10mL0.1mol•L-1KClO3溶液和10mL0.3mol•L-1NaHSO3溶液,插入温度计 |
|
II |
生成的Cl-对反应有催化作用,加快了反应速率 |
取10mL0.1mol•L-1KClO3溶液于烧杯中,先加入少量 固体,再加入10mL0.3mol•L-1NaHSO3溶液 |
|
III |
反应中溶液酸性增强,加快了反应速率 |
分别向a、b两个烧杯中加入10mL0.1mol•L-1KClO3溶液;向烧杯a中加入1mL蒸馏水,向烧杯b中加入1mL0.2mol•L-1盐酸;再分别向两个烧杯中加入10mL0.3mol•L-1NaHSO3溶液 |
①补全方案I中的假设:。
②方案II中加入的固体为(填化学式)。
③除I、II、III中的假设外,还可以提出的假设是。
④某同学从控制变量的角度思考,认为方案III中实验操作设计不严谨,请进行改进:。
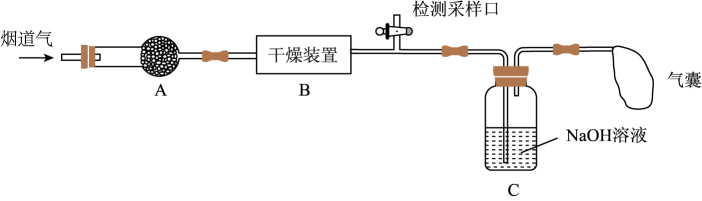
已知:NO、NO2能与NaOH溶液发生如下反应:NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO2+ NaNO3+H2O;但NO不能单独与NaOH溶液反应。
a.碱石灰 b.浓硫酸 c.五水合硫酸铜(CuSO4•5H2O)
a.≥1 b.=1 c.≤1
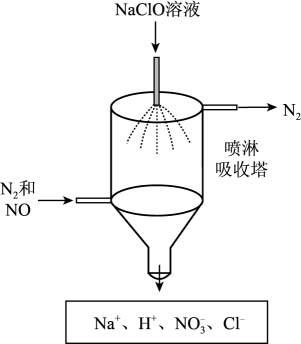
①NaClO溶液吸收NO时发生反应的离子方程式为。
②该装置的优点是。
①向装置C的吸收液中加入适量H2O2溶液,充分反应后,蒸发浓缩,得到c(NO)为0.1000mol·L-1的溶液甲。写出H2O2溶液将吸收液中的NO
氧化为NO
的离子方程式:。
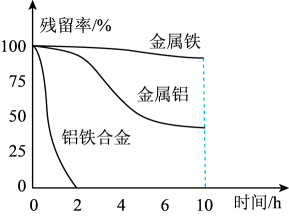
②量取三份50mL溶液甲,分别用金属铝、金属铁和铝铁合金在45℃、惰性气体氛围中将溶液甲中的NO还原为N2 , 从而实现脱氮,溶液中NO
的残留率(残留率=
×100%)与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是。