










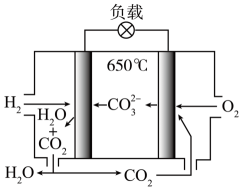

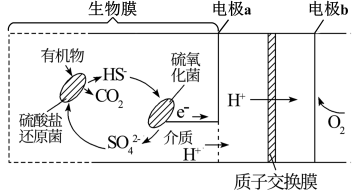



一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染。
已知:①
②
则
=。


①一定温度下,向体积为0.5L的密闭容器中通入2molNO和1.5molO2反应,平衡时NO的转化率为50%,求该温度下反应的平衡常数K=L/mol。
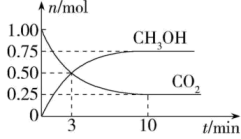
②在某体积恒定的密闭容器中,通入2mol NO和1molO2 , 反应经历相同时间,测得不同温度下NO的转化率如图,则150℃时,v(正)v(逆)(填“”、“
”或“
”)。
③判断在恒温恒容条件下该反应已达到平衡状态的是(填字母)。
A. B.反应容器中压强不随时间变化而变化
C.混合气体颜色深浅保持不变 D.混合气体质量保持不变

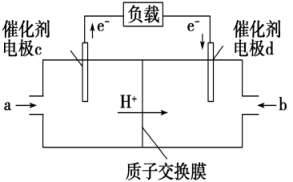
①则电极c是(填“正极”或“负极”),电极d的电极反应式。
②若线路中转移1mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为L。