
已知:①4FeWO4+O2+4Na2CO32Fe2O3+4Na2WO4+4CO2
②2MnWO4+O2+2Na2CO32MnO2+2Na2WO4+2CO2


已知“降温收尘”后,粗 中含有的几种物质的沸点:
|
物质 |
|
|
|
|
|
沸点/ |
136 |
127 |
57 |
180 |
回答下列问题:

|
物质 |
|
|
|
|
|
分压/ |
|
|
|
|
①该温度下, 与C、
反应的总化学方程式为;
②随着温度升高,尾气中 的含量升高,原因是。

已知:①该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
金属离子 | ||||
开始沉淀pH | 1.9 | 7.0 | 3.0 | 8.1 |
完全沉淀pH | 3.2 | 9.0 | 4.7 | 10.1 |
②、
、
远大于
。
③一般认为平衡常数反应较完全。
回答下列问题:


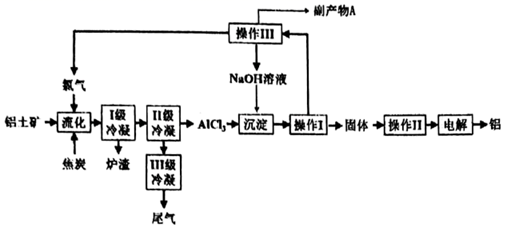
已知几种氯化物在常压时的熔、沸点:
| 物质 | SiCl4 | AlCl3 | NaCl | KCl | CaCl2 |
| 沸点/℃ | 58 | 180 | 1465 | — | 1935 |
| 熔点/℃ | -69 | — | 801 | 771 | 775 |
回答下列问题:
①“流化过程中NaAlSi3O8发生的化学反应方程式为.
②Ⅱ级冷凝的温度不能高于℃

a.平衡常数到达最大值
b.反应物不再转化为生成物
c.炉内Ca2SiO4与CaO·MgO的质量比保持不变
d.单位时间内,n(CaO·MgO)消耗 :n(Ca2SiO4)生成 = 2:1
|
MgCl2 |
MgO |
|
|
熔点/℃ |
712 |
2850 |
①镁原子核外有种能量不同的电子,它们的运动状态有种。
②MgCl2的电子式为;
③判断工业上应选择MgCl2还是MgO作为电解原料并说明理由

已知:氯磷灰石高温下易被氧化为 。某化学兴趣小组以黄铜矿为原料进行如下实验探究。请根据题意回答相关问题:

①酸性高锰酸钾溶液的作用是。
②滴定过程中涉及反应有: 、(写离子方程式),终点现象为。
③滴定至终点时,消耗标准液体积 ,矿样中硫元素的质量百分含量为(结果保留两位有效数字),若
不通过
,则测定结果会(填“偏高”、“偏低”、“不影响”)。

实验开始时的操作依次为(填写序号)。
①检查装置的气密性 ②通入 气体 ③收集
并检验其纯度 ④组装仪器 ⑤点燃酒精灯 ⑥加装药品
步骤①溶解熔渣选用的试剂最好是,步骤②加入 的目的是将
还原(硫元素被氧化为
),发生反应的离子方程式为,步骤③的系列操作为、(用乙醇)洗涤、干燥。

已知:室温下钛不与X2(X表示Cl、Br、I)、O2、H2O反应,也不与强酸、强碱甚至王水反应。但高温下易与氧气、氮气、碳和氢气反应。
回答下列问题。
|
温度/℃ |
30 |
20 |
14 |
10 |
5 |
1 |
-6 |
|
溶解度/(g∙L-1) |
88 |
70 |
48 |
43 |
35 |
25 |
14 |
热分解法是金属冶炼方法之一。以Ag2O为原料冶炼银的化学方程式为。

在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式__。

① a反应中每生成1molFeSO4转移电子的物质的量为mol。
② d反应的离子方程式为。

①冶炼过程中,正极周围溶液的pH(选填:“增大”、“减小”或“不变”)
②负极产生单质硫的电极反应式为。
|
相关反应 |
反应热 |
平衡常数K |
|
FeS2(s) + H2(g) |
ΔH1 |
K1 |
|
1/2 FeS2(s) + H2(g) |
ΔH2 |
K2 |
|
FeS(s) + H2(g) |
ΔH3 |
K3 |

①上述反应中,ΔH10(选填:“>”或“<”)。
②提高硫的脱除率可采取的措施有(举1例)。
③1000K时,平衡常数的对数lgK1、lgK2和lgK3之间的关系为。

已知:①25℃,Ksp(CaCO3)=8.7×10-9;Ksp(CaSO4)=2.5×10-5;
②Be(OH)2与Al(OH)3性质相似。
回答下列问题:


已知:①VO3-+2H+ VO2++H2O
②NH4VO3微溶于冷水,易溶于热水,不溶于乙醇

①氢气燃烧热值高。实验测得,在常温常压下,1molH2完全燃烧生成液态水,放出285.8kJ热量。则表示H2燃烧热的热化学方程式是(填字母代号)。
A.H2(g)+ O2(g)=H2O(g) △H=+285.8kJ·mol-1
B.H2(g)+ O2(g)=H2O(1) △H=-285.8kJ·mol-1
C.H2(g)+ O2(g)=H2O(1) △H=+285.8kJ·mol-1
D.H2+ O2=H2O △H=-285.8kJ·mol-1
②氢氧燃料电池能量转化率高,具有广阔的发展前景。氢氧燃料电池中,发生还原反应的物质是(填“氢气”或“氧气”。
③氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ·mol-1
反应达到平衡后,升高温度则反应速率(填“增大”或“减小”);平衡将向 (填“正反应方向”或“逆反应方向”)移动。
①该电池的负极材料是;电池工作时,阳离子向 (填“正极”或“负极”)移动。
②电极材料锌可由闪锌矿在空气中般烧成氧化锌,然后用碳还原氧化锌来制取,该反应的化学方程式为ZnO+C Zn+CO↑,此法属 (填字母代号)。
A.电解法B.热还原法C.热分解法
①混合溶液的pH=8的原因:(用离子方程式表示)。
②混合溶液中由水电离出的c(H+)(填“>“<”或“=’)0.1mol·L-1NaOH溶液中由水电离出的c(H+)。
③现有NaA与HA混合溶液,若pH=7,则溶液中c(Na+)c(A-)(填“>”“<”或“=”)。


①阴极电极反应式为 。
②工业生产中,阳极材料要定期补充,其原因是:。
a.工业上可以用热还原法来制取Ga
b.酸性:Al(OH)3>Ga(OH)3
c.由最外层电子数相同可知,镓与铝的化学性质相似
d.可用GaCl3溶液、氨水和盐酸设计实验证明Ga(OH)3的两性
表1 温度对锰脱除效果的影响
温度/℃ | ρ(Mn2+)/mg·L-1 | 除锰率/% |
10 | 0.325 | 87.9 |
30 | 0.341 | 89.5 |
50 | 0.424 | 84.3 |
70 | 0.646 | 76.1 |
表2 反应时间对锰脱除效果的影响
时间/h | ρ(Mn2+)/mg·L-1 | 除锰率/% |
1.0 | 0.995 | 63.1 |
1.5 | 0.794 | 70.6 |
2.0 | 0.328 | 87.9 |
2.5 | 0.325 | 87.9 |
有关数据如表:
熔点℃ | 沸点℃ | 密度 (g/cm3) | |
Na | 97.8 | 882.9 | 0.97 |
K | 63.7 | 774 | 0.86 |
NaCl | 801 | 1413 | 2.165 |
KCl | 770 | 1500 | 1.984 |
将碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]和焦炭按一定比例混合,放入真空管式炉中先升温至500℃保持一段时间,然后升温至1450℃反应制得镁。
①用碳还原法制备金属镁需要在真空中而不在空气中进行,其原因是。
②焦炭与碱式碳酸镁的物质的量的比值不同对镁的还原率有较大影响,结果如图。当比值大于15∶1时,还原率下降的原因可能是。
③碱式碳酸镁分解如图所示,写出在1450℃反应制得镁的化学反应方程式。


工业采用电解MgCl2溶液产生Mg(OH)2 , 如图。然后用Mg(OH)2悬浊液吸收烟气中的二氧化碳,减少二氧化碳的排放同时产生碱式碳酸镁。该电池的阴极电极反应式为。电解时还得到副产物为。

火法炼铜:Cu2S+O2 2Cu+SO2
湿法炼铜:CuSO4+Fe═FeSO4+Cu
上述两种方法中,铜元素均被(填“氧化”或“还原”)成铜单质.
方法一:用FeCl3溶液浸泡印刷电路板制备CuCl2•2H2O,实验室模拟回收过程如下:
![]()
①证明步骤Ⅰ所加FeCl3溶液过量的方法是.
②步骤2中所加的氧化剂最适宜的是.
A.HNO3B.H2O2C.KMnO4
③步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的“试剂1”是.(写出一种即可)
④蒸发农缩CuCl2溶液时,要滴加浓盐酸,目的是(用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2•2H2O.
方法二:用H2O2和稀硫酸共同浸泡印刷电路板制备硫酸铜时,其热化学方程式是:
Cu(s)+H2O2(l)+H2SO4(nq)═CuSO4(aq)+2H2O(l)△H1=﹣320kJ/mol
又知:2H2O(l)═2H2O(l)+O2(g)△H2=﹣196kJ/mol
H2(g)+ O2(g)═H2O(l)△H3=﹣286kJ/mol
则反应Cu(s)+H2SO4(aq)═CuSO4(aq)+H2(g)的△H=.
