




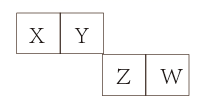
Q | R | ||
Z | M | ||
X | Y |




①25℃时相关物质的Ksp见下表。
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Co(OH)2 |
Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-32.3 | 1×10-12.7 | 1.09×10-15 |
②氢氧化氧锰(MnOOH)难溶于水和碱性溶液;“沉淀池I”的条件下,Co2+不能被二氧化锰氧化。
A. B.
B. C.
C. D.
D.
热稳定性: H2SHCl (选填 “<”、“> ” 或 “=”, 下同); 酸性:HClO4H2SO4;用一个离子方程式说明氯元素和硫元素非金属性的相对强弱:。

已知:气体A是两种气体的混合物,气体B、C均为纯净物,且B可使带火星的木条复燃。
回答下列问题:

①该单质的晶体类型为
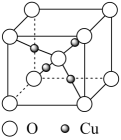
②从图1中取出该物质的晶胞如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。例如图2中原子1的坐标为(0,0,0),原子2的坐标为(1,1,1),则原子3和原子4的坐标分别为、。

③根据图1中所给的数据,阿伏加德罗常数的值为NA , 石墨的密度为g/cm3。(列出计算式)

①化合物M的熔沸点明显低于化合物N,其主要原因是。
②化合物N中C原子的杂化类型为,元素C、N、O的第一电离能由小到大的顺序为。

a.简单立方堆积 b.体心立方堆积 c.面心立方最密堆积


根据判断出的元素回答下列问题:

①钛网与直流电源的极相连;
②石墨电极的电极反应式为;
③写出生成葡萄糖酸的化学反应方程式:。