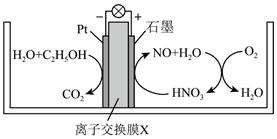

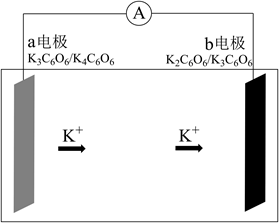
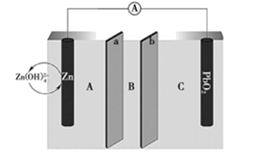
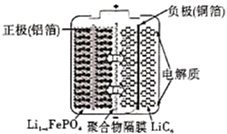
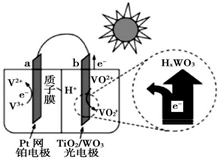

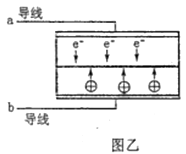

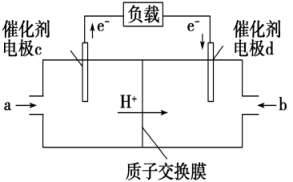
①则电极c是(填“正极”或“负极”),电极d的电极反应式。
②若线路中转移1mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为L。
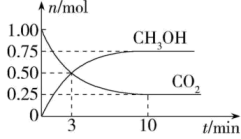
由CO2催化加氢合成甲醇。
①一定条件下,由CO2和H2制备甲醇的过程中有下列反应:
反应1:CO2(g)+H2(g)CO(g)+H2O(g) △H1
反应2:CO(g)+2H2(g)CH3OH(g) △H2
反应3:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H3
其对应的平衡常数分别为K1、K2、K3 , 它们随温度变化的曲线如图所示。
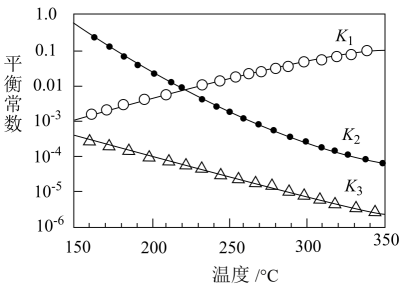
①则△H2△H3(填“>”“<”或“=”)。
②对于上述CO2加氢合成CH3OH的反应体系,下列说法不正确的是(填字母)。
a.增大初始投料比 , 有利于提高CO2的转化率
b.当气体的平均摩尔质量保持不变时,说明反应体系已达平衡
c.体系达平衡后,若压缩容器体积,则反应1平衡不移动,反应3平衡正向移动
d.选用合适的催化剂可以提高反应3中CO2的平衡转化率
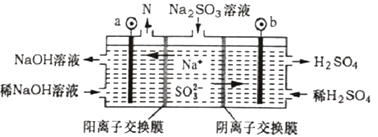
在光电催化条件下可以高效地将CO2和H2O转化为甲醇,从电极反应的角度分析:
①甲醇在(填“阴”或“阳”)极生成;
②氧化反应为。
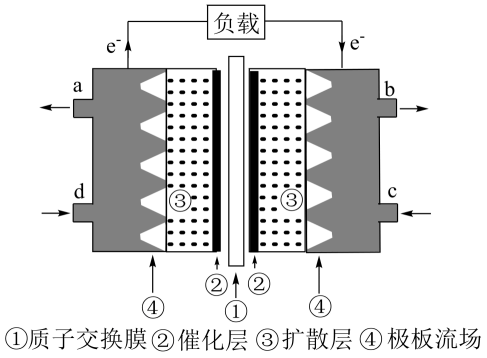
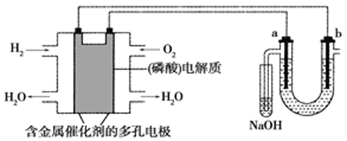
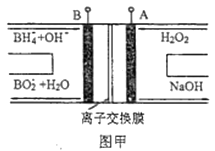
该电池工作时,c口通入的物质是。
以硫酸镍(NiSO4)为原料制备Ni(OH)2的主要过程如下图所示。制备过程中,降低Ni(OH)2沉淀速率,可以避免沉淀团聚,提升电池性能。
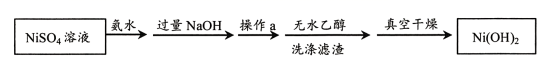
已知:Ni2++6NH3•H2O⇌[Ni(NH3)6]2++6H2O
操作a是 。
①先加氨水的目的是 。
②用化学平衡移动原理分析加入NaOH需过量的原因是。
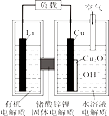
主要步骤:①将Ni(OH)2和Cd(OH)2固定,中间以隔膜隔开(如下图所示);②将多组上述结构串联;③向电池中注入KOH溶液;④密封。
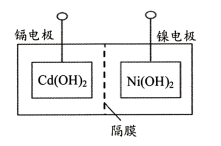
下列对镍镉电池组装和使用的分析正确的是(填字母序号)。
a.密封镍镉电池可以避免KOH变质
b.镍电极为电池的负极,镉电极为电池的正极
c.电池组装后,应先充电,再使用
电池充电时,若Cd(OH)2和Ni(OH)2耗尽后继续充电,会造成安全隐患,称为过度充电。制造电池时,在镉电极加入过量的Cd(OH)2可对电池进行过度充电保护,该方法称为镉氧循环法。
Cd(OH)2耗尽后继续充电,镉电极上生成的物质为。
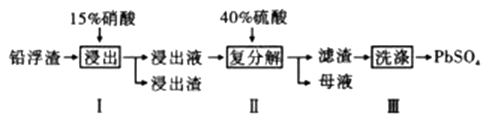
已知:Ksp(PbSO4)=1.6×10-8 Ksp(CaSO4)=4.9×10-5
A.稀硫酸
B.稀盐酸
C.硝酸铅溶液
D.酒精
_ _Fe2(SO4)3+H2O +Na2CO3 =Na2Fe6(SO4)4(OH)12↓+Na2SO4 +CO2↑