
A | B | C | D |
|
|
|
|
测定维生素C浓度 | 除去H2S气体中的HCl杂质 | 在铁上镀铜 | 实验室制备并收集氨气 |
Ⅰ.向容器中加入一定量2%AgNO3溶液,边振荡边滴加2%氨水至沉淀恰好完全溶解;
Ⅱ.加入10%葡萄糖溶液至充满容器,在60~70℃水浴中加热,片刻后容器内壁便镀上一层银。
下列说法正确的是( )
装置示意图 | 序号 | 电解质溶液 | 实验现象 |
| ① | 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有 | |
② | 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无 |
下列说法错误的是( )
| | | | |
| A.在铁上镀铜 | B.进行铝热反应 | C.蒸干 | D.证明溴乙烷、NaOH、乙醇溶液共热生成乙烯 |

A.在铁制品上镀铜 | B.探究浓度对反应速率的影响 | C.检验乙炔具有还原性 | D.制备NH4Cl固体 |
|
|
|
|
 B .
B .  C .
C .  D .
D . 
 B . 景泰蓝(铜-釉)
B . 景泰蓝(铜-釉) C . 沙金戒指(铜-金)
C . 沙金戒指(铜-金) D . 手镯(金-玉石)
D . 手镯(金-玉石)
铝片表面除去油垢后,用2mol/LNaOH溶液在60~70℃下洗涤,除去铝表面薄氧化膜,离子方程式为:;再用10%(质量分数)的HNO3溶液对铝片表面进行化学抛光。若取一定体积68%(质量分数)的浓硝酸配制该化学抛光液,需要用到的玻璃仪器有、、玻璃棒和胶头滴管。
取预处理过的铝片和铅做电极,控制电流恒定为0.06A,用直流电源在5~6mol/L硫酸中电解。其中铝片接电源极,产生氧化膜的电极反应式为氧化膜的生长过程可大致分为A、B、C三个阶段(如图所示),C阶段多孔层产生孔隙的离子反应方程式为,A阶段电压逐渐增大的原因是。

取出阳极氧化并封闭处理过的铝片,洗净、干燥,在铝片表面滴一滴氧化膜质量检查液(3gK2Cr2O7+75mL水+25mL浓硫酸),用秒表测定表面颜色变为绿色(产生Cr3+)所需时间,可判断氧化膜的耐腐蚀性。写出该变色反应的离子方程式:。
①取氧化完毕的铝片,测得表面积为4.0cm2 , 洗净吹干,称得质量为0.7654g;
②将铝片浸于60℃的溶膜液中煮沸10分钟进行溶膜处理;
③取出铝片,洗净吹干,称得除膜后铝片质量为0.7442g。
已知氧化膜的密度为2.7g/cm3 , 可以计算得出氧化膜厚度为μm(1μm=1×10-4cm)。

已知:①矿粉的主要成分是 、ZnS,还含有少量FeS、CuS、
等。
②酸浸时反应之一: 。该生产过程中,
与
不反应。
③ 的氧化性与溶液pH有关。
请回答:
称取一定质量的铁钉,放入烧杯中→()→()→()→()→()
a.加过量浓硫酸
b.加过量稀硫酸
c.置于坩埚中,小火烘干
d.置于石棉网上,小火烘干
e.取出,用蒸馏水洗涤
f.搅拌,至气泡速率突然减小
g.用电子天平称量
h.用托盘天平称量
①下列关于实验过程的说法,正确的是(填字母)。
A.先在滤纸上称量好 粉末,再倒入锥形瓶
B.配制 溶液时宜在棕色容量瓶中进行
C.“振荡至充分反应”时,锥形瓶须加塞密封
D.滴定时的指示剂是
E.滴定终点后仰视读数,会导致 纯度偏大
②读取滴定管中 溶液的示数时,因溶液颜色的干扰,凹液面最低点无法准确定位,此时可改为读取处的示数。

已知:部分阳离子以氢氧化物的形式完全沉淀时的 如下表所示。
| 沉淀物 | | | | |
| | 5.2 | 3.2 | 9.7 | 9.2 |
①操作X的名称是
② 在强碱溶液中用
氧化,可制得碱性镍镉电池电极材料—
,该反应的离子方程式是

①写出镀件表面生成的电极反应:。
②氯离子含量过多或过少均会对镀层效果产生影响,因此要测定电镀液中氯离子的含量。实验室中用以下方法原理测定氯离子的浓度:取的电镀液,向其中加入3-5滴
的
溶液,用
的
标准溶液进行滴定,至出现稳定的粉红色时消耗
标准溶液
。
资料:为粉红色沉淀。
测得电镀液中。
③过量的可通过向电镀液中加入
(微溶)固体除去,结合化学用语解释原因:。

直流电源为乙醇()燃料电池,电解质溶液为
溶液,则B电极的电极反应式为。
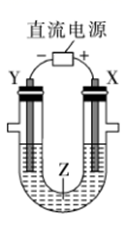
如图所示,则c为电源的极;该发生器中发生反应的离子方程式为。



①每个晶胞中所含的氢键数目为;
②设NA为阿伏加德罗常数的值,晶胞边长为anm,则晶胞密度为g·cm-3。

为防止金属Fe被腐蚀,可以采用上述(填装置序号)装置原理进行防护;装置③中总反应的离子方程式为。


①图乙中Co电极应连接乙醇燃料电池的极(填“a”或“b”。
②图甲中a极上发生的电极反应是。
③生成 , Ⅰ室溶液质量理论上减少g。

则电池工作时(选填“a”或“b”)为负极,b 极的电极反应式为。

①待镀零件与电源相连。
方法Ⅱ:化学镀。将待镀零件浸泡在含有Ni2+和H2PO2-的溶液中,在酸性等条件下发生下述反应:
(a)Ni2++H2PO2-+→Ni ++H2PO3-+,
(b)6H2PO2-+ 2H+= 2P+ 4H2PO3-+ 3H2↑
上述反应可在塑料镀件表面沉积镍—磷合金,从而达到化学镀镍的目的。
②写出并配平反应式(a)。

已知:酸浸后滤液中含有Ni2+、Al3+、Fe3+、Mn2+;Ksp[Fe(OH)3]=4.0×10-38 , Ksp[Al(OH)3]=1.0×10-33 , Ksp[Ni(OH)2]=1.6×10-14;
①“氧化除锰”是将锰元素最终转化为MnO2而除去,反应历程如下:
i.5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+;
ii.(用离子方程式表示)。
②调pH=5操作时,已知溶液中Ni2+浓度为2.0mol/L,则“滤渣II”中是否存在Ni(OH)2沉淀?(列式计算,并使用必要的文字说明)。

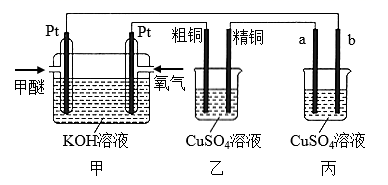
②乙中为 100 mL NaCl 溶液(足量),滴有酚酞,丙为 CuSO4 溶液。
③若 c、d 为惰性电极,通电时 c 电极附近首先出现红色。 请回答下列问题:

