



选项 | 生产活动 | 化学原理 |
A | 使用碳纳米管、石墨烯制作新型电池 | 碳纳米管、石墨烯均可燃烧生成 |
B | 侯氏制碱法得到 |
|
C | 利用 | Fe的活动性比Cu强 |
D | 常温下,可以利用钢瓶储存浓 | 常温下浓 |


方法①:将、
、C按一定比例混合,在高温下煅烧制得产品;
方法②:将、
、
按一定比例混合,在高温下煅烧制得产品。
下列说法正确的是


①在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是.
②吸收液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如下表:
n(SO32﹣):n(HSO3﹣) | 91:9 | 1:l | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
由上表判断,NaHSO3溶液显性(填“酸”、“碱”或“中”),用化学平衡原理解释:.
③当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下:
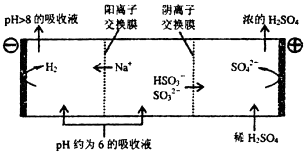
写出HSO3﹣在阳极放电的电极反应式:,当阴极室中溶液pH升至8以上时,吸收液再生并循环利用.
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g);△H=﹣574kJ•mol﹣1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H=﹣1160kJ•mol﹣1
若用标准状况下4.48L CH4还原NO2至N2 , 整个过程中转移的电子总数为(阿伏加德罗常数的值用NA表示),放出的热量为kJ.
一定条件下,将CO(g)与H2O(g)以体积比为1:2置于密闭容器中发生上述反应,达到平衡时测得CO(g)与H2O(g)体积比为1:6,则平衡常数K=.
甲醇是重要的化工原料,又可作为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) ![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-58 kJ/mol
CH3OH(g)+H2O(g) ΔH=-58 kJ/mol
③CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH=+41 kJ/mol
CO(g)+H2O(g) ΔH=+41 kJ/mol
回答下列问题:
已知反应①中相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | x |
则x=。
若将1mol CO2和2mol H2充入容积为2L的恒容密闭容器中,在两种不同温度下发生反应②。测得CH3OH的物质的量随时间的变化如图所示。

①曲线I、Ⅱ对应的平衡常数大小关系为KIKⅡ(填“>”或“=”或“<”);
②一定温度下,能判断该反应达到化学平衡状态的是。
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=O断裂的同时有6个H—H断裂
③若5min后反应达到平衡状态,H2的转化率为90%,则用CO2表示的平均反应速率为,该温度下的平衡常数为;若容器容积不变,下列措施可增加甲醇产率的是。
a.缩小反应容器的容积 b.使用合适的催化剂
c.充入He d.按原比例再充入CO2和H2
以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池。以此电池作电源,在实验室中模拟铝制品表面“钝化”处理过程(装置如图所示)。其中物质b是,阳极电极反应为。


据此判断:
①该反应的△Η 0(填“>”或“<”),△S0(填“>”或“<”)
②在T1温度下,0~2s内的平均反应速率v(N2)=.
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若增大催化剂的表面积,则CO转化率(填“增大”,“减少”或“不变”)
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是(填字母).

①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
例如:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=﹣867.0kJ•mol﹣1
2NO2(g)⇌N2O4(g)△H=﹣56.9kJ•mol﹣1
写出CH4催化还原N2O4(g)生成N2和H2O(g)的热化学方程式.
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的.图2是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图.电极a、b表面发生的电极反应式分别为
a:,
b:.

部分阳离子以氢氧化物形式沉淀时的pH如下:
|
沉淀物 |
开始沉淀时的pH |
完全沉淀时的pH |
|
Al(OH)3 |
3.8 |
5.2 |
|
Fe(OH)3 |
2.7 |
3.2 |
|
Fe(OH)2 |
7.6 |
9.7 |
|
Ni(OH)2 |
7.1 |
9.2 |

①用15.0mL2.0mol•L﹣1氨水吸收标准状况下448mLSO2 , 吸收液中的溶质为
②某同学用酸性KMnO4溶液滴定上述吸收液,当达到滴定终点时,消耗KMnO4溶液25.00mL,则酸性KMnO4溶液中,c(KMnO4)=

氨气燃料电池的电解质溶液最好选择(填“酸性”“碱性”或“中性”)溶液,氮气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池总反应的化学方程式是,负极的电极反应式是.
6Ag(s)+O3(g)═3Ag2O(s)△H=﹣235.8kJ/mol.
已知2Ag2O(s)═4Ag(s)+O2(g)△H=+62.2kJ/mol,
则常温下反应:2O3(g)═3O2(g)的△H=.
①溶液酸碱性的影响:其他条件相同,将4﹣CP加入到不同pH的Na2S2O8溶液中,结果如图a所示.由此可知:溶液酸性增强,(填“有利于”或“不利于”)Na2S2O8产生SO4﹣ .

②Fe2+浓度的影响:相同条件下,将不同浓度的FeSO4溶液分别加入c(4﹣CP)=1.56×10﹣4mol•L﹣1、c(Na2S2O8)=3.12×10﹣3 mol•L﹣1的混合溶液中.反应240min后测得实验结果如图b所示.已知 S2O82﹣+Fe2+═SO4﹣•+SO42﹣+Fe3+ . 则由图示可知下列说法正确的是:(填序号)
A.反应开始一段时间内4﹣CP降解率随Fe2+浓度的增大而增大,原因是Fe2+能使Na2S2O8产生更多的SO4ˉ•.
B.Fe2+是4﹣CP降解反应的催化剂
C.当c(Fe2+)过大时,4﹣CP降解率反而下降,原因可能是Fe2+会与SO4﹣•发生反应,消耗部分SO4﹣•.
D.4﹣CP降解率反而下降,原因可能是生成的Fe3+水解使溶液的酸性增强,不利于4﹣CP的降解.
③当c(Fe2+)=3.2×10ˉ3mol•L﹣1时,4﹣CP降解的平均反应速率的计算表达式为.

则该电源负极反应为.
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为.
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变如表中反应条件x,该平衡体系中随x递增y递增的是(选填序号).
选项 | a | b | c | d |
x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时的甲的转化率 |
③向含4molV 的最高价含氧酸的稀溶液中,逐渐加入Fe粉至过量.假设生成的气体只有一种,请在图2坐标系中画出n(Fe2+)随n(Fe)变化的示意图.

已知:2C(s)+O2(g)═2CO(G)△H2=﹣221kJ•mol﹣1
C(s)+O2(g)═CO2(g)△H=﹣393.5kJ•mol﹣1
则N2(g)+O2(g)═2NO(g)△H=kJ•mol﹣1
时间/s | 0 | 2 | 3 | 4 | 5 |
c(NO)/10﹣4mol•L﹣1 | 10.0 | c1 | 1.50 | 1.00 | 1.00 |
c(CO)10﹣3mol•L﹣1 | 3.60 | c2 | 2.75 | 2.70 | 2.70 |
①c1合理的数值为(填字母) A.4.20 B.4.00 C.3.50 D.2.50
②前2s内的平均反应速率 v(CO2 )=
③不能作为判断该反应达到平衡状态的标志是.(填字母标号)
a.2v正(CO)=v逆(N2)
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
实验 序号 | T/℃ | NO初始浓 度/10﹣3mol•L﹣1 | CO初始浓 度/10﹣3mol•L﹣1 | 催化剂的比表面积/㎡•g﹣1 |
① | 350 | 1.20 | 5.80 | 124 |
② | 280 | 1.20 | 5.80 | 124 |
③ | 280 | 1.20 | 5.80 | 82 |
则曲线I、Ⅱ、Ⅲ对应的实验编号依次为
已知:CO通入新制的银氨溶液可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体.某温度下,向1L密闭容器中充入1molNO和1molCO,反应达到平衡后,将平衡混合气通入足量新制的银氨溶液中.生成43.2g Ag,则该温度下,反应:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)的化学平衡常数K=
2CO2(g)+N2(g)的化学平衡常数K=
反应Ⅰ:CO(g)+2H2(g)⇌CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是(填“I”或“Ⅱ”).
②下表所列数据是反应I在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断△H10 (填“>”、“=”或“<”).
③某温度下,将2mol CO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为,此时的温度为(从上表中选择).
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=﹣1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=﹣566.0kJ/mol
③H2O(g)=H2O(l)△H=﹣44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:

①该电池正极的电极反应为.
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为.