|
选项 |
性质差异 |
结构因素 |
|
A |
沸点:正戊烷(36.1℃)高于新戊烷(9.5℃) |
分子间作用力 |
|
B |
熔点: |
晶体类型 |
|
C |
酸性: |
羟基极性 |
|
D |
溶解度(20℃): |
阴离子电荷 |

下列说法正确的是
 ,则X可能为P
B . 在
,则X可能为P
B . 在

已知:或
;a、b、c、d、e分别表示
、
、
、
、
中的一种。
。

下列说法错误的是



①
②
回答下列问题:


若要在家中将它们区分开来,下列方法中可行的是。
a.在水杯中各盛相同质量的样品,分别加入等体积的白醋,观察反应的剧烈程度
b.分别用干净铁丝蘸取样品在煤气灶的火焰上灼烧,观察火焰颜色
c.将样品溶解,分别加入澄清石灰水,观察是否有白色沉淀
d.分别放在炒锅中加热,观察是否有残留物

甲、乙两条线中表示向溶液中滴加盐酸的是,理由是。丙、丁两条线中表示向
溶液中滴加盐酸的是,理由是。
中C元素的化合价是,写出
的电离方程式。

①三水三草酸合铁酸钾[]为翠绿色晶体,光照易分解,
是一种稳定的配离子,能类似于
中的
在溶液中稳定存在。
和
存在如下平衡:
ⅰ.
ⅱ.
②相同条件下,草酸根(C2O)的还原性强于
③为黄色固体,微溶于水,可溶于强酸
【实验】探究Fe3+和草酸根在溶液中的反应。
操作 | 现象 |
在避光处,向10mL 0.5 | 得到翠绿色溶液和翠绿色晶体 |
取实验中少量晶体洗净,配成溶液,滴加KSCN溶液,不变红,原因是(结合ⅰ、ⅱ平衡,用必要的化学用语和数据解释原因),继续加入硫酸,溶液变红,说明加入硫酸,与
结合使ⅱ平衡移动(填“正向”或“逆向”)。经检验发现上述实验中
和
未发生氧化还原反应。
溶质 | NaClO | Na2CO3 | NaHCO3 | Na2SiO3 | Na2SO3 | NaHSO3 |
pH | 10.3 | 11.6 | 9.7 | 12.3 | 10.0 | 4.0 |
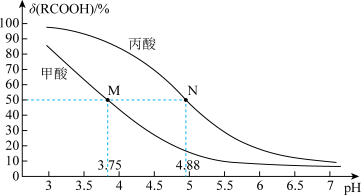
常温下,相同物质的量浓度的下列稀溶液,其酸性由强到弱的顺序是(填序号) 。
a.H2CO3 b.H2SO3 c.H2SiO3
六种溶液中,水的电离程度最小的是(填化学式)。
①配平上面Fe2(SO4)3再生的化学方程式,并标出电子转移的数目和方向。
②硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍。由图1和图2判断,使用硫杆菌的最佳条件为;若反应温度过高,反应速率下降,其原因是。

温度(℃) | c(氨水)(mol/L) | 电离度(%) | c(OH-)(mol/L) |
0 | 16.56 | 9.098 | 1.507×10-2 |
10 | 15.16 | 10.18 | 1.543×10-2 |
20 | 13.63 | 11.2 | 1.527×10-2 |
①温度升高,NH3·H2O的电离平衡向(填“左”、“右”)移动。
②表中c(OH-)基本不变的原因是。
实验1:测定某浓度的NaHSO3溶液的pH,测得pH为5.2。
实验2:向0.10mol·L-1NaHSO3溶液中加氨水至pH=7。
实验3:向0.10mol·L-1Na2SO3溶液中滴几滴0.10mol·L-1FeCl3溶液,再滴加KSCN溶液,溶液不变红。
实验4:向0.10mol·L-1Na2SO3溶液中加入BaO2固体,有气体产生,同时有白色沉淀。
下列说法错误的是( )
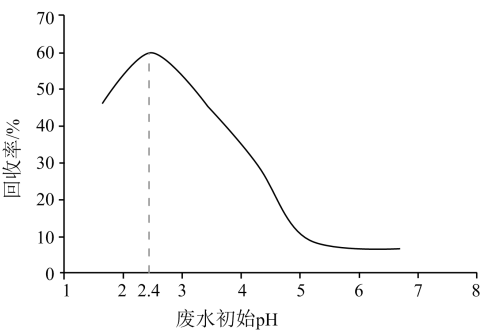
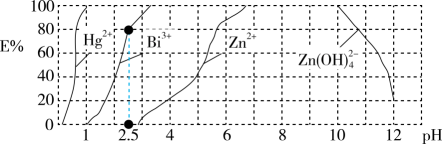
①pH>7时高锰酸钾将废水中的硫化物氧化为S,该反应的离子方程式为。
②研究发现:其他条件相同时,废水呈酸性时硫化物的去除率明显大于呈碱性时去除率,则可能的原因。

①适当增大活性炭表面的水膜pH,H2S的氧化去除率增大的原因是。
②若水膜过厚,H2S的氧化去除率减小的原因是。


N-N | N≡N | P-P | P≡P |
193 | 946 | 197 | 489 |
从能量角度看,氮以N2、而白磷以P4(结构式为 )形式存在的原因是,白磷中P原子的杂化方式为。
)形式存在的原因是,白磷中P原子的杂化方式为。

如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为。

①若晶胞底边的边长均为apm、高为cpm,阿伏加德罗常数的值为NA , 晶体的密度g·cm-3(写出表达式)。
②晶胞在x轴方向的投影图为(填标号)。


已知A中反应的化学方程式:2FeSO4·7H2O Fe2O3+SO2↑+SO3↑+14H2O,实验开始前打开活塞K1、K2 , 关闭活塞K3 , 通入一段时间N2后,关闭活塞K1、K2 , 打开活塞K3 , 高温加热绿矾。
完成下列填空:
为探究SO2与钡盐溶液的反应,在装置C中先后四次加入不同的溶液:
① | ② | ③ | ④ |
已煮沸的BaCl2溶液 | 未煮沸的BaCl2溶液 | 已煮沸的Ba(NO3)2溶液 | 未煮沸的Ba(NO3)2溶液 |
注:锥形瓶中溶液体积相同,钡盐溶液浓度相同;油层厚度一致,通入SO2流速一致。 | |||
得到如下pH-t图:

a.气体通入速率过快 b.沉淀未进行恒重操作
c.收集的气体中有CO2 d.未用食用油覆盖液面

①反应原理过程中X为 (填名称)。
②写出检验X所需试剂及实验现象。

②利用氨水作吸收液生成 ,是当前有效捕捉
的方法之一、下列有关说法错误的是
A.该方法的优势在于生成的 易分解,可实现吸收液的再生
B. 溶液中存在
C. 溶液中存在
D.已知 ,可推测
溶液呈酸性

①下列描述正确的是。
A.若 ,则
最大
B.在 前,
,在
时,
C.若 ,则a点
的平衡转化率等于
的平衡转化率
D.若反应一段时间后 和
的体积分数相同可判断上述反应达平衡
②图中在 时,不同的投料比
转化率趋于相近的原因是。
①在t℃下,向2L恒容的密闭容器中充入 和
进行催化重整反应,平衡后测得
和CO的体积分数相等,则t℃下该反应的平衡常数。
②催化重整时,催化剂活性会因积碳增多而降低,有关积碳和消碳反应如下:
积碳反应:
消碳反应:
在一定的温度下,增大 的浓度,有助于增大催化剂活性的原因是。
| 化学式 | H2SeO3 | H2CO3 |
| 电离平衡常数 | K1=2.7×10-3 K2=2.5×10-8 | K1=4.3×10-7 K2=5.6×10-11 |
若向Na2CO3溶液中通入过量SeO2 , 则下列反应的离子方程式正确的是_______。