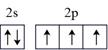
 B . 氮原子的结构示意图为
B . 氮原子的结构示意图为 C .
C . 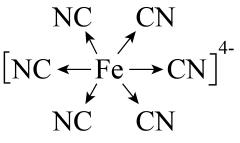
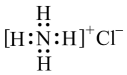 C . 硫离子的核外电子排布式 1s22s22p63s23p4
D . 基态到激发态产生的光谱是发射光谱
C . 硫离子的核外电子排布式 1s22s22p63s23p4
D . 基态到激发态产生的光谱是发射光谱
选项 | 事实 | 解释 |
A | NH3的热稳定性比PH3强 | NH3分子间能形成氢键 |
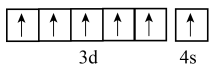
B | 基态Fe3+比Fe2+稳定 | 基态Fe3+价电子排布式为3d5 , 是半充满的稳定结构 |
C | 石墨能够导电 | 石墨是离子晶体 |
D | CH4与H2O分子的空间构型不同 | 它们中心原子杂化轨道类型不同 |
 B .
B .  D .
D . 
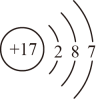 C . 基态碳原子价层电子轨道表示式为:
C . 基态碳原子价层电子轨道表示式为: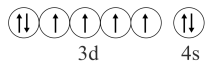 C . 用电子式表示
C . 用电子式表示 D .
D . 
 B .
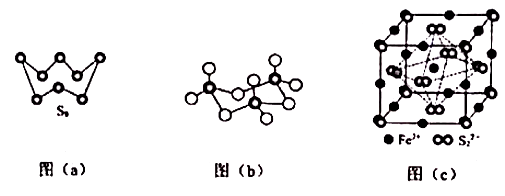
B . ![]() 与
与 ![]() 中含σ键个数比为3:2
中含σ键个数比为3:2

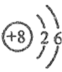 D .
D .  B . NH3中只存在极性共价键
C . NH4Cl的电子式:
B . NH3中只存在极性共价键
C . NH4Cl的电子式: D . NaHCO3的电离方程式:NaHCO3=Na++H++CO
D . NaHCO3的电离方程式:NaHCO3=Na++H++CO

电池充电时,LiFeO4脱出部分Li+ , 形成Li1−xFePO4 , 结构示意图如(b)所示,则x=,n(Fe2+ )∶n(Fe3+)=。
H2S | S | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
A. 
B. 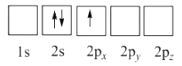
C. 
D. 
A.离子键
B.σ键
C.π键
D.氢键
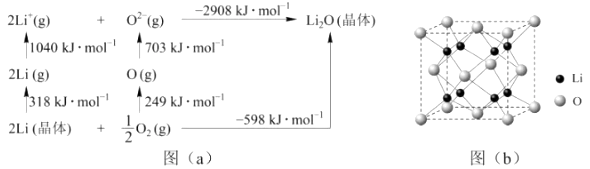
可知,Li原子的第一电离能为kJ·mol-1 , O=O键键能为kJ·mol-1 , Li2O晶格能为kJ·mol-1
伏加德罗常数的值为NA , 则Li2O的密度为 g/cm3(列出计算式)。
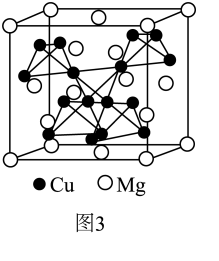
①铜原子基态电子排布式为;
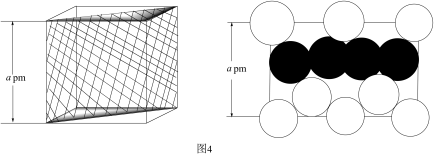
②用晶体的x射线衍射法可以测得阿伏加德罗常数.对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm.又知铜的密度为9.00g•cm﹣3 , 则镉晶胞的体积是cm3、晶胞的质量是g,阿伏加德罗常数为
(列式计算,已知Ar(Cu)=63.6);

GaAs的熔点为1238℃,密度为ρ g•cm﹣3 , 其晶胞结构如图所示.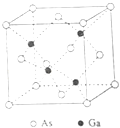
该晶体的类型为,Ga与As以键键合.Ga和As的摩尔质量分别为MGa g•mol﹣1和MAs g•mol﹣1 , 原子半径分别为rGa pm和rAs pm,阿伏加德罗常数值为NA , 则GaAs晶胞中原子的体积占晶胞体积的百分率为.
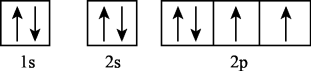
a.1s²2s²2p²3p¹ b.1s²2s²2p4 c.1s²2s²2p²3s¹ d.1s²2s²2p³
已知:①典型N-N、N=N和N≡N的键长分别为1.40×10⁻10m、1.20×10⁻10m和1.09×10⁻10m;②甲酸根的两个碳氧键键长相同,处于典型碳氧单键键长和碳氧双键键长之间,其结构可以用两个极端电子式( )的平均杂化体来表示。试画出HN3分子的两个极端电子式;“
)的平均杂化体来表示。试画出HN3分子的两个极端电子式;“![]() ”中N原子的杂化方式为。
”中N原子的杂化方式为。

①与Co同周期,基态原子有1个未成对电子的元素有种。
②配离子的空间构型为,钴元素价态为,通过整合作用形成的配位键有个。
③配合物A无顺磁性,则中心离子的杂化方式为(填标号)。(若中心离子具有单电子,则配合物为顺磁性物质。)
A. B.
C.
D.
④咪唑(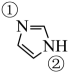 )具有类似苯环的芳香性,①号N比②号N更易与钴形成配位键的原因是。
)具有类似苯环的芳香性,①号N比②号N更易与钴形成配位键的原因是。
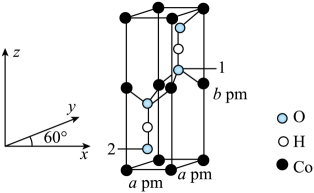
已知晶胞含对称中心,其中1号氧原子的分数坐标为(0.6667,0.6667,0.6077),则2号氧原子的分数坐标为。为阿伏加德罗常数的值,该晶体的密度为
(用计算式表示)。
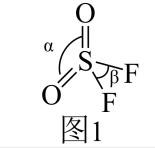
①COCl2中C、O和Cl元素的电负性由大到小的顺序是 (用元素符号表示)。
②CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2分子的空间构型是 (填“平面四边形”或“四面体形”)。

①阴离子中碳原子的杂化轨道类型是。
②在丙二酸根与Cr3+配位时,配位原子为1号氧而不是2号氧的原因是。
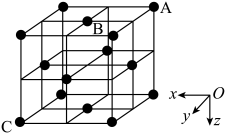
①下列为晶胞中Cr原子沿x轴方向的投影的是( 填字母)。
a.  b.
b. 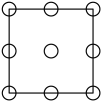 c.
c. 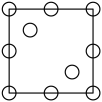 d.
d. 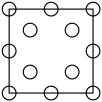
②若晶胞中最近的Cr原子和N原子相切,原子半径分别为r(Cr) nm和r(N) nm;晶胞中N原子的坐标是A(0,0,0)、B( ,
, 0) ,则距A和B最近的Cr原子的坐标是,该原子到C原子的距离是nm[用含r(Cr)、r(N)的代数式表示]。
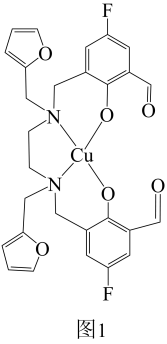
基态Cu原子价层电子轨道表示式为 ,其原子核外电子占据的最高能层符号为。
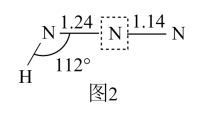
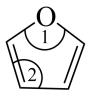 中∠1(填“>”、“<”或“=”)∠2。
中∠1(填“>”、“<”或“=”)∠2。
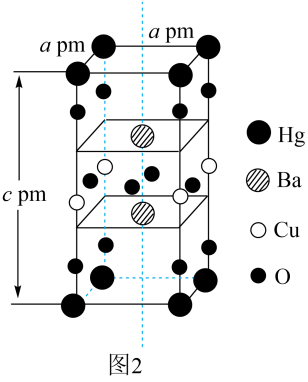
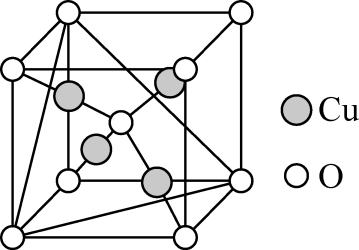
该晶胞中O、Cu、Ba、Hg原子的个数比为。
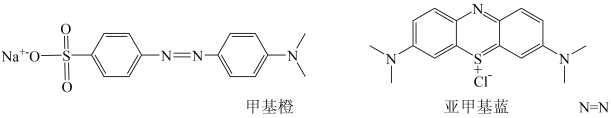
①的空间构型是。
②甲基橙、亚甲基蓝中C原子的杂化类型有,
③常温下,CO2、HCHO在水中溶解度之比大约是1:500,其主要原因是。
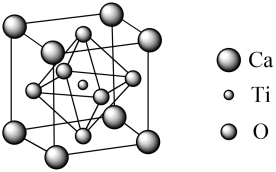

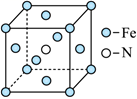
分解得
。
的空间结构为 。
体积水可溶解
体积
,
体积水可溶解约
体积
。
极易溶于水的原因是 。
反应时,向饱和
溶液中先通入的气体是 。
存在配位键,提供孤电子对的原子是 。
比较沸点:
填“
”或“
”
。
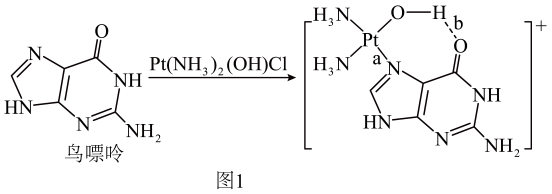
②在Pt(NH3)2Cl2中,配体与铂(II)的结合能力:ClNH3(选填“>”或“<”)。
③与NH3互为等电子体的分子和离子有、(各举一例)。
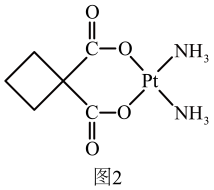
①碳铂中含有的作用力有(填字母)。
A.极性共价键 B.非极性共价键|C.配位键 D.离子键 E.金属键 F.σ键 G.π键
②碳铂分子中采用sp3和sp2杂化的原子个数比。
顺铂 | 反铂 | |
结构 |
|
|
25℃时溶解度/g | 0.2577 | 0.0366 |
①推测Pt( NH3) 2Cl2中Pt的杂化轨道类型不是sp3 , 依据是。
②顺铂在水中的溶解度大于反铂的原因是。
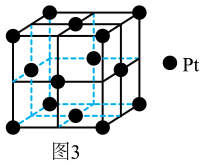
①晶胞中铂(Pt) 原子的配位数为 。
②紧邻的两个Pt原子的距离为 pm, 晶体的摩尔体积Vm =cm3·mol-1(用含a的代数式表示,阿伏加德罗常数为NA , 单位物质的量的物质所具有的体积叫做摩尔体积)。