元素 | 元素性质或原子结构 |
X | 原子核外s能级上的电子总数与p能级上的电子总数相等,但第一电离能低于同周期相邻元素 |
Y | 原子核外s能级上的电子总数与p能级上的电子总数相等,但第一电离能高于同周期相邻元素 |
Z | 其价电子中,在不同形状的原子轨道中运动的电子数相等 |
N | 只有一个不成对电子 |

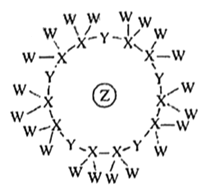


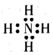 D . 一定条件下,m能与Z的单质反应生成p
D . 一定条件下,m能与Z的单质反应生成p

元素符号 | Li | Be | Na | S | Cl |
原子半径/pm | 152 | 89 | 186 | 102 | 99 |
由此可推理:决定原子半径大小的因素有
①的沸点(-33.5℃)高于
的沸点(-129℃)的主要原因是
②的一种下游产品三聚氟氰(分子式为:
),分子结构中显示有环状结构,请从价键理论和物质的相对稳定性角度写出三聚氟氰的结构式。

尿素中N的第一电离能比O的高,原因是:
①O失去的是已经配对的电子,配对电子相互排斥,因而电离能较低;
②。
a.NH3的键角小于CH4的键角,是因为NH3的中心原子上孤电子对有较大斥力
b.NH3极易溶解在水中,只因氨分子与水分子间形成了氢键
c.NH3的沸点比PH3的高,是因为N—H的键能比P—H的大
氧化锆(化学式为ZrO2)晶胞结构如图所示,Zr4+在晶胞中的配位数是,若该晶胞的密度为ρg·cm-3 , 用NA表示阿伏加德罗常数的值,则该晶胞的体积是cm3(列出计算式)。(氧化锆的摩尔质量M=123g·mol-1)

元素 | 电离能(kJ·mol-1) | ||
I1 | I2 | I3 | |
Mn | 717 | 1509 | 3248 |
Fe | 759 | 1561 | 2957 |
①铁元素位于元素周期表族,属于区。
②比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子更难,请从原子结构分析原因。
①请将方程式补充完整并配平。
CrO42-+ S+ H2O→ Cr(OH)3↓+ S2O32-+
②上述反应中,若转移了3mol电子,得到的还原产物是mol。
③Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,写出Cr(OH)3的电离方程式。
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
元素 | 相关信息 |
Y | 原子核外有6个不同运动状态的电子 |
Z | 非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同 |
W | 主族元素,与Z原子的价电子数相同 |
R | 价层电子排布式为3d64s2 |
M | IB族,其被称作“电器工业的主角” |
请回答下列问题(Y、Z、W、R、M用所对应的元素符号表示):

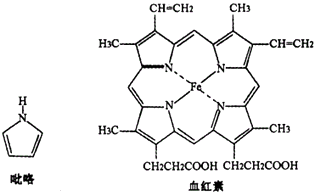
①已知吡咯中的各个原子均在同一平面内;则吡咯分子中N原子的杂化类型为。
②1mol吡咯分子中所含的σ键总数为个;分子中的大π键可用Π 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为。
③C、N、O三种元素的简单氢化物键角由小到大的顺序为(填化学式),原因是。
④血液中的O2是由血红素在人体内形成的血红蛋白来输送的,则血红蛋白中的Fe2+与O2是通过键相结合。
|
t(s) |
0 |
50 |
100 |
250 |
350 |
|
n(mol) |
0.5 |
0.42 |
0.41 |
0.40 |
0.40 |
则 100s 时, PCl3的物质的量浓度是。