选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 电解海水制取氯气和金属钠 |
|
B | 高温,高压下, | 升高温度、增大压强均可使反应物分子中活化分子的百分数增加 |
C | 从煤的干馏产物中获得苯、甲苯等化工原料 | 煤的干馏是物理变化 |
D | 以赤铁矿(主要成分 |
|
煤燃烧产生的CO2在光能和光催化剂存在的条件下可与H2O(g)转化为CH4和O2 , 反应的化学方程式为.紫外光照射时,等量的CO2和H2O(g)在不同催化剂(I、Ⅱ)作用下,CH4产量随光照时间的变化如图2所示,光照t小时后催化剂Ⅱ作用下CH4的产量开始高于催化剂I,其原因可能是

a.煤是由有机物和少量无机物组成的复杂混合物
b.煤在燃烧过程中会生成一氧化碳、二氧化硫、氮氧化物、烟尘等有害物质
c.可利用生石灰、熟石灰、石灰石等固硫剂使煤在燃烧过程中生成稳定的硫酸盐
d.煤的干馏属于化学变化、煤的气化和液化都属于物理变化
燃煤烟气的一种脱硫方案﹣火碱一石灰一石膏法流程图1如下. 
①常温下,用NaOH溶液吸收SO2得到pH=6的NaHSO3溶液,该溶液中离子浓度的大小顺序是
②氢氧化钙与NaHSO3反应的化学方程式是
Ⅱ.2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=﹣23.5kJ•mol﹣1
Ⅲ.CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=﹣41.3kJ•mol﹣1
①总反应热化学方程式:3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)△H=;
②Y(Y1、Y2),X可分别代表压强或温度.如图2表示Y一定时,总反应中CO的平衡转化率随X的变化关系.判断Y1、Y2的大小关系,并简述理由:.
|
温度/℃ |
400 |
500 |
|
平衡常数K |
9 |
5.3 |
①该反应升高到一定温度时,反应将不能正向进行,由此判断该反应的△S(填“>”或“<”")0。
②在容积为10 L的密闭容器中通入0.1 mol CO(g)和0.1 mol H2O(g)发生反应,在400℃时反应达到平衡,此时CO(g)的转化率为。
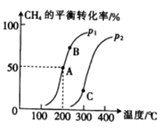
①200 ℃时,该反应的平衡常数K=。
②A、B、C三点的平衡常数KA、KB、KC的大小关系是。
③压强:p1 (填“>”“<”或“=”)p2。

A.干馏 B.萃取 C.分液


